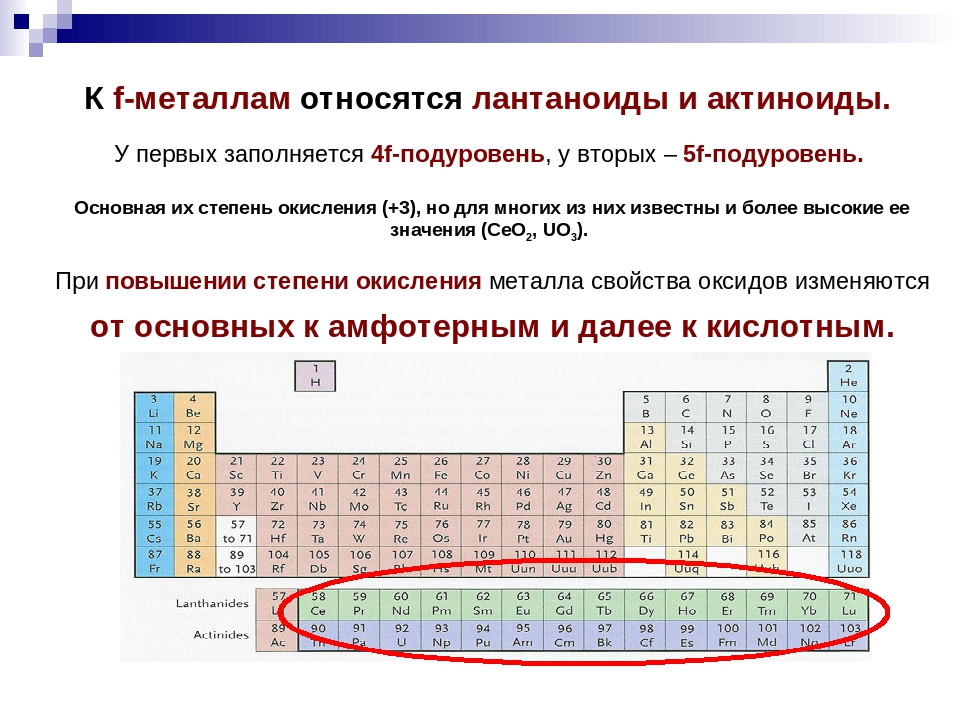
Химические свойства лантаноидов
Задача 1061.
Чем объясняется сходство химических свойств лантаноидов?Решение:
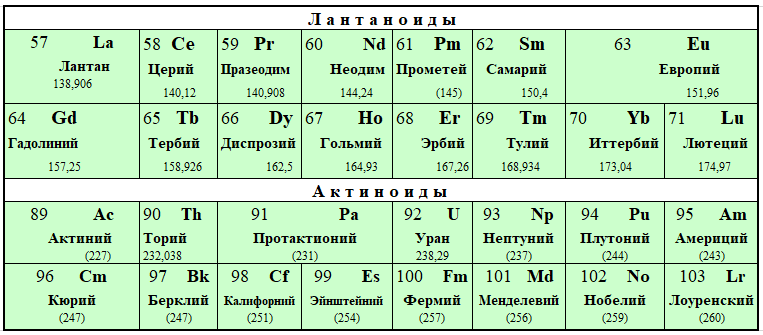
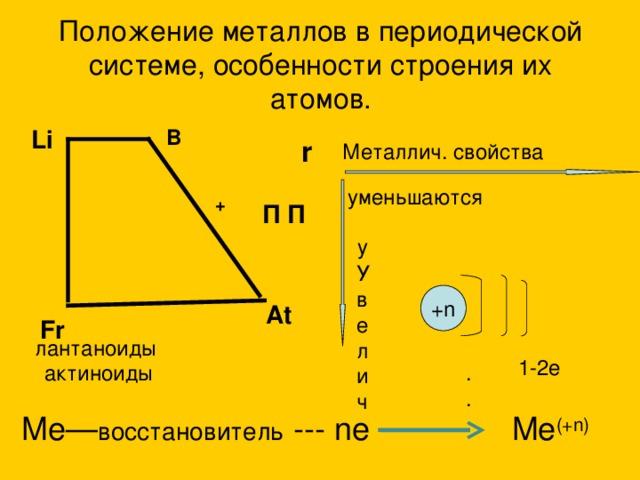
К семейству лантаноидов принадлежат четырнадцать f-элементов, следующих в периодической системе после лантана (элементы № 58 – № 71). С возрастанием порядкового номера элементов этого семейства происходит заполнение электронами подуровня третьего снаружи электронного слоя (4f-подуровня), строение же наружного, а у некоторых элементов и следующего за ним слоёв, остаются неизменными. По этой причине все лантаноиды очень близки друг к другу по химическим свойствам. Электроны заполняют 4f-, а не 5-дуровень потому, что в этом случае они обладают меньшей энергией. Однако разница в энергиях 4f- и 5d-состояний очень мала. Благодаря этому один из 4f-элементов (у некоторых, например, у церия, два 4f-электрона) легко возбуждаются, переходя на 5d-подуровень. Поэтому в большинстве своих соединений лантаноиды имеют степень окисления +3, а не +2. Это обстоятельство объясняет близость свойств лантаноидов и скандия. Лантаноиды образуют сульфиды, хлориды, оксиды – солеподобные, нерастворимые, тугоплавкие соединения. Гидроксиды М(ОН)3 – сильные основания. Катионы М3+ сильно гидратируются. С анионами одноосновных кислот и серной кислотой лантаноиды дают растворимые соли. Лантаноиды образуют многочисленные комплексные соединения. Соли их имеют различное яркое окрашивание, что возможно объяснить переходом 4f-электрона на 5d-подуровень.
Лантаноидное сжатие
Задача 1062.
Что такое лантаноидное сжатие? Как оно сказывается на свойствах d-элементов 6 периода?Решение:
С ростом атомного номера у лантаноидов наблюдается значительное уменьшение металлических и ионных радиусов (от 102 пм у церия Се до 96,1 пм у лютеция Lu). Это явление называется лантаноидным сжатием. Оно является причиной значительного роста плотности лантаноидов: от 6,19 у лантана La до 9,87 у лютеция Lu.
Основная причина лантаноидного сжатия заключается в недостаточном экранировании заряда ядра электронами 4f-орбитали.
В атомах, обладающих единственным электроном, среднее расстояние между ядром и электроном определяется электронной орбиталью, на которой находится электрон, и уменьшается с ростом заряда ядра, тем самым приводя к уменьшению величины атомного радиуса. атомах, обладающих более чем одним электроном, степень уменьшения атомного радиуса вследствие увеличения заряда ядра ослабляется вследствие увеличения электростатического отталкивания между электронами.
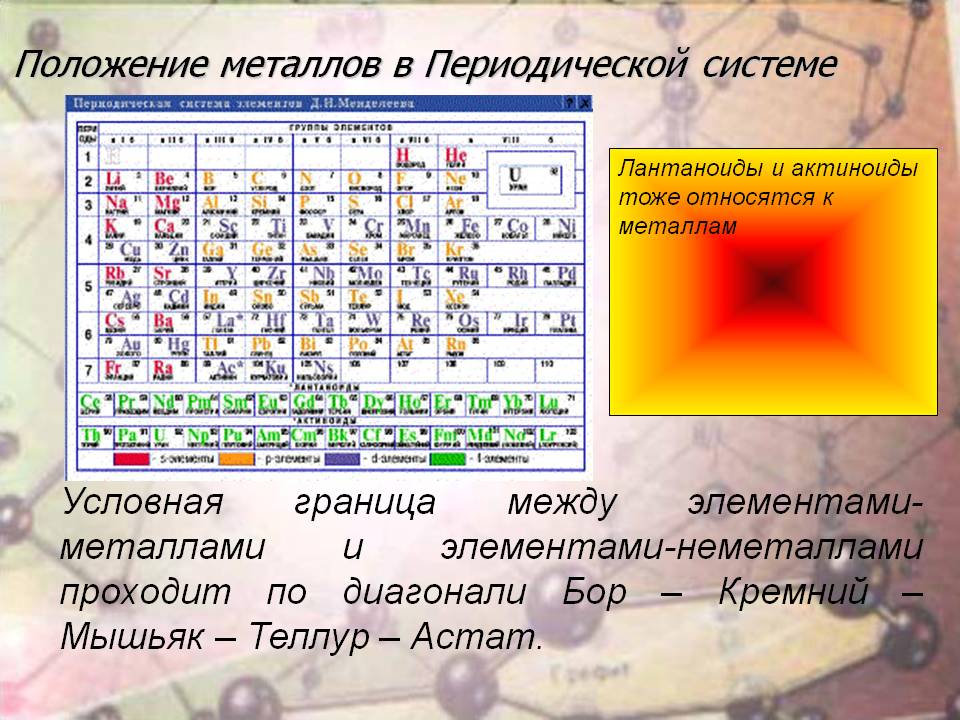
Свойства Периодической системы элементов
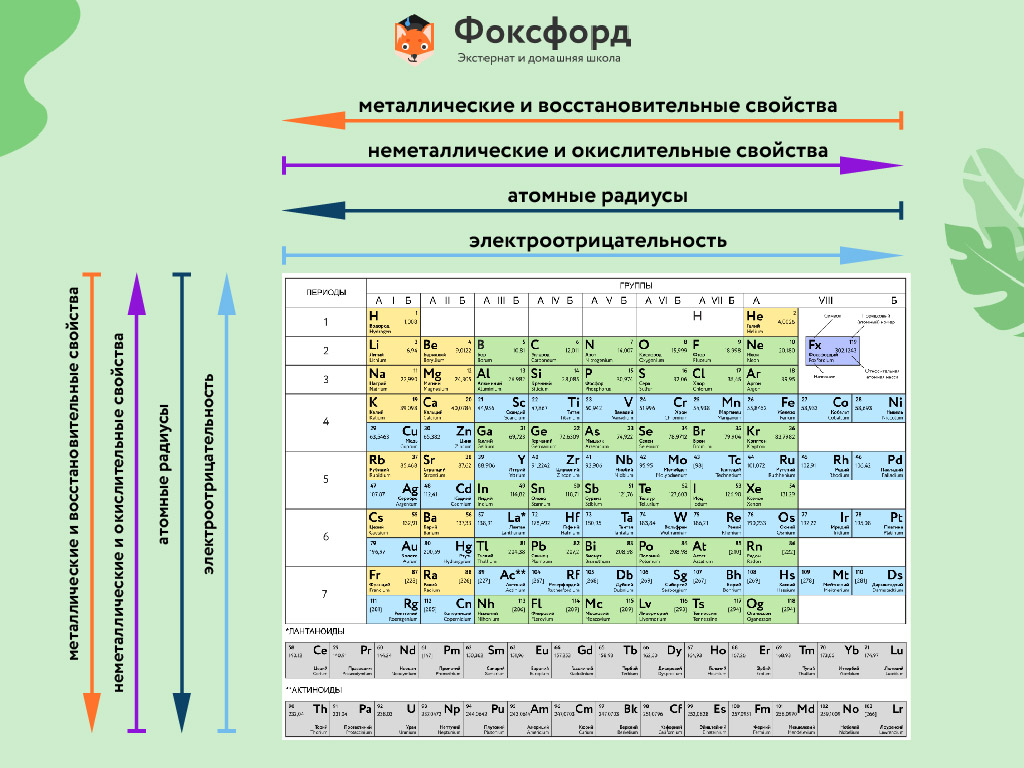
Расположение химических элементов в таблице Менделеева позволяет сопоставлять не только их атомные массы, но и химические свойства.
Вот как они изменяются в пределах группы (сверху вниз):
- Металлические свойства усиливаются, неметаллические ослабевают.
- Увеличивается атомный радиус.
- Усиливаются основные свойства гидроксидов и кислотные свойства водородных соединений неметаллов.
В пределах периодов (слева направо) свойства элементов меняются следующим образом:
- Металлические свойства ослабевают, неметаллические усиливаются.
- Уменьшается атомный радиус.
- Возрастает электроотрицательность.
Примечания и ссылки
- Иногда они написаны лантаноиды в связи с ИЮПАК по рекомендации для вызова этих элементов лантаноиды на английском языке для того , чтобы избежать путаницы с минеральными анионами , которые на английском языке имеют суффикс -ide : фторид для ионов фторида F – , хлорид для ионов хлора Cl – , галогенид для галогенида , сульфида для сульфида и т. д. В английском языке эта рекомендация мало соблюдается, во французском она тем более, тем более что в нашем языке не существует путаницы с минеральными анионами.
- (in) , раздел 1: Основные константы, единицы и коэффициенты преобразования , подраздел: Электронная конфигурация нейтральных атомов в основном состоянии , 84- е онлайн-издание, CRC Press, Бока-Ратон, Флорида, 2003.
- (in) Родерик П. Макдональд , Использование фильтра из оксида гольмия в спектрофотометрии , Clinical Chemistry , Vol. 10, декабрь 1964, стр. 1117-1120
- (in) Альберт К. Левин и Фрэнк С. Палилла , Новый высокоэффективный катодолюминесцентный люминофор с красным светом (YVO 4: Eu) для цветного телевидения » , Applied Physics Letters , vol. 5, п о 6,15 сентября 1964 г., стр. 118-120
- (in) Мэтью Р. Макдональд, Джефферсон Э. Бейтс, Джозеф В. Циллер, Филипп Фурче и Уильям Дж. Эванс , Завершение серии двух ионов лантаноидов для элементов: синтез молекулярных комплексов Pr 2+ , Gd2 +., Tb 2+ и Lu 2+ » , Журнал Американского химического общества , т. 135, п о 26,3 июля 2013 г., стр. 9857-9868
Периодический закон
К середине XIX века учёные располагали множеством сведений о физических и химических свойствах разных элементов и их соединений. Появилась необходимость упорядочить эти знания и представить их в наглядном виде. Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Пытался решить эту задачу и молодой русский профессор Д.И. Менделеев. Он собирал и классифицировал информацию о свойствах элементов и их соединений, а затем уточнял её в ходе многочисленных экспериментов. Собрав данные, Дмитрий Иванович записал сведения о каждом элементе на карточки, раскладывал их на столе и многократно перемещал, пытаясь выстроить логическую систему. Долгие научные изыскания привели его к выводу, что свойства элементов и их соединений изменяются с возрастанием атомной массы, однако не монотонно, а периодически.
Так был открыт периодический закон, который учёный сформулировал следующим образом: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».

Своё открытие Менделеев совершил почти за 30 лет до того, как учёным удалось понять структуру атома. Открытия в области атомной физики позволили установить, что свойства элементов определяются не атомной массой, а зависят от количества электронов, содержащихся в нём. Поэтому современная формулировка закона звучит так:
Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Этот принцип Менделеев проиллюстрировал в таблице, в которой были представлены все 63 известных на тот момент химических элемента. При её создании учёный предпринял ряд весьма смелых шагов.
<<Форма демодоступа>>
Во-первых, многочисленные эксперименты позволили Менделееву сделать вывод, что атомные массы некоторых элементов ранее были вычислены неправильно, и он изменил их в соответствии со своей системой.
Во-вторых, в таблице были оставлены места для новых элементов, открытие которых учёный предсказал, подробно описав их свойства.

Первый вариант Периодической таблицы элементов, составленной Д.И. Менделеевым.
Мировое научное сообщество поначалу скептически отнеслось к открытию русского химика. Однако вскоре были открыты предсказанные им химические элементы: галлий, скандий и германий. Это разрушило сомнения в правильности системы Менделеева, которая навсегда изменила науку. Там, где раньше учёному требовалось провести ряд сложнейших (и даже не всегда возможных в реальности) опытов — теперь стало достаточно одного взгляда в таблицу.
Теперь расскажем, как устроена Периодическая таблица элементов Менделеева и как ею пользоваться.
Индивидуальные доказательства
- Вольфганг Либшер, Эккехард Флюк: Систематическая номенклатура неорганической химии . Springer-Verlag, Берлин 1999, ISBN 3-540-63097-X .
- Номенклатура неорганической химии, Рекомендации ИЮПАК 2005 .
- AM Mariano: Экономическая геология редкоземельных минералов . В: Б. Р. Липин, Г. А. Маккей (ред.): Обзоры по минералогии , том 21 – Геохимия и минералогия редкоземельных элементов (1989). Опубликовано Минералогическим обществом Америки, ISBN 0-939950-25-1 , стр. 309-337.
- Георг Штайнхаузер : Структурная химия – Прикосновение к пустоте. В кн . : Новости химии. 66, 2018, стр 118,. DOI : .
- А. Ф. Holleman , Е. Wiberg , Н. Wiberg : Учебник неорганической химии . 102-е издание. Вальтер де Грюйтер, Берлин 2007, ISBN 978-3-11-017770-1 , стр. 1937.
- ДТВ атлас по химии . 1981 , часть 1. С. 220.
- ↑
Атом и молекула лантана. Формула лантана. Строение атома лантана:
Лантан (лат. Lanthanum, от др.-греч. λανθάνω – «скрываюсь», «таюсь») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением La и атомным номером 57. Расположен в 3-й группе (по старой классификации – побочной подгруппе третьей группы), шестом периоде периодической системы.
Лантан – металл. Относится к редкоземельным элементам, а также к группе переходных металлов и к лантаноидам.
Как простое вещество лантан при нормальных условиях представляет собой мягкий, ковкий, вязкий, блестящий металл серебристо-белого цвета.
Молекула лантана одноатомна.
Химическая формула лантана La.
Электронная конфигурация атома лантана 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 5d1 6s2 или 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f 5s2 5p6 5d1 6s2. Потенциал ионизации (первый электрон) атома лантана равен 538,09 кДж/моль (5,5769(6) эВ).
Строение атома лантана. Атом лантана состоит из положительно заряженного ядра (+57), вокруг которого по шести оболочкам движутся 57 электронов. При этом 55 электронов находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку лантан расположен в шестом периоде, оболочек всего шесть. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлены s- и р-орбиталями. Третья, четвертая и пятая – внутренние оболочки представлены s-, р- и d-орбиталями. Шестая – внешняя оболочка представлена s-орбиталью. На внутреннем энергетическом уровне атома лантана на 5d-орбитали находится один неспаренный электрон. На внешнем энергетическом уровне атома лантана на 6s-орбитали находятся два спаренных электрона. В свою очередь ядро атома лантана состоит из 57 протонов и 82 нейтронов. Лантан относится к элементам f-семейства.
Радиус атома лантана (вычисленный) составляет: нет данных. Эмпирический радиус атома лантана составляет 195 пм.
Атомная масса атома лантана составляет 138,90547(7) а. е. м.
Лантан вместе с церием и неодимом относится к наиболее распространенным редкоземельным элементам. Содержание лантана в земной коре составляет 0,0034 %, в морской воде и океане – 3,4×10–10 %.
Получение лантаноидов
Основной способ получения лантаноидов – восстановление металлов из их окислов водородом или другими восстановителями.
А.Н.Даапе и Ф.Спендинг разработали двухстадийный способ получения элементарного диспрозия. Сначала окись диспрозия превращают в фторид, на который затем действуют металлическим кальцием при быстром нагревании:
Dy 2 O 3 + 6HF → 2DyF 3 + ЗН 2 О 2DyF 3 + ОСА 1500 ? C → 3CaF 2 + 2Dy
Такой способ позволяет получать металл высокой чистоты. Тербий получают, восстанавливая Тb 2 О с кальцием или электролизом расплава ТbС1 3. Благодаря внедрению передовых технологий получения лантаноидов, такие, как ионный обмен, зонная плавка, экстракция, получают металлы с высоким выходом и высокой чистоты.
Теоретически с бромида самария можно выделить чистый металл. Однако при взаимодействии с активными металлами основная масса исходного вещества сублимируется:
SmBr 2 + Ва → Sm + ВаВr 2.
Лантан получают из монацита в несколько стадий. Первая стадия концентрации происходит уже на драге. Плотность монацита 4,9-5,3, а привычного песка – в среднем 2,7 г / см 3. При такой разнице в весе гравитационное разделение не представляет особого труда. Но, кроме монацита, в тех же песках есть другие тяжелые минералы. Поэтому чтобы получить монацитового концентрат чистотой 92-96%, применяют комплекс гравитационных, магнитных и электростатических методов обогащения. В результате попутно получают ильменитовый рутил, цирконовые и другие ценные концентраты.
Как и всякий минерал, монацит надо “раскрыть”. Чаще монацитового концентрат обрабатывают для этого концентрированной серной кислотой. Сульфаты редкоземельных элементов и тория, образующиеся выщелачивают обычной водой. После того, как они перейдут в раствор, в осадке остаются кремнезем и часть циркона, не отделилась на предыдущих стадиях.
На следующей стадии разделения извлекают короткоживущих радий-228, а затем и торий – иногда вместе с церием, иногда отдельно. Отделение церия от лантана и смеси Ланта-ноиды не особо сложное: в отличие от них, он способен проявлять валентность 4 + и в виде гидроксида Се (ОН) 4 переходить в осадок, тогда как его трехвалентные аналоги остаются в растворе. Стоит отметить, что операция отделения церия, как, впрочем, и предыдущие, проводится много раз – чтобы как можно полнее “выжать” дорогой редкоземельный концентрат.
После того, как церий, выделенный в растворе всего лантана (в виде нитрата Lа (NO 3) 3, поскольку на одной из промежуточных стадий серная кислота была заменена азотной, чтобы облегчить дальнейшее разделение). Из этого раствора и получают лантан, добавляя аммиак, нитраты аммония и кад-мию. При наличии Сd (NO 3) 2 разделение более полно. С помощью этих веществ все лантаноиды переходят в осадок, в фильтрате же остаются лишь кадмий и лантан. Кадмий облагаются сероводородом, отделяют осадок, а раствор нитрата лантана еще несколько раз очищают дробной кристаллизацией от примесей лантаноидов.
Таким образом, получают хлорид лантана LаС1 3 -. Электролизом расплавленного хлорида дает лантан чистотой до 99,5%. Еще чище лантан (99,79% и выше) получают кальциетермичним способом. Такая традиционная классическая технология.
Области применения лантана
Несмотря на то что, металлы группы лантаноидов очень малочисленно в земной коре, их используют в промышленности достаточно широко.
Из материалов, содержащих лантан, изготовляют колесики чрезвычайно популярных и востребованных зажигалок.

Так, оксид лантана применяют для изготовления оптических стекол (так называемого лантанового стекла). Линзы, призмы, изготовленные с применением этого металла, используются в фото- и киноаппаратуре, в астрономической оптике.
Хромит лантана, который легирован магнием, стронцием или кальцием применяется в изготовлении надежных и высокотемпературных нагревателей, способных работать с температурой до 1780 градусов Цельсия в кислородной атмосфере. С возрастанием температуры сопротивление хромита лантана уменьшается. Коэффициент термического расширения химического элемента лантана достаточно низкий, вследствие этого электронагреватели отличаются значительной долговечностью.
Оксиды лантана используются в синтезировании сверхпроводников, которые предназначены для работы в условиях высоких температур.
Нашел свое применение химический элемент лантан в изготовлении специальных стекол, предназначенных для остекления помещений. Такие полотна, в структуру которых входят соединения лантана, имеют уникальные свойства, они способны снижать температуру в помещениях до 7 градусов.
Лантано-никелевые сплавы (гидриды) широко используются в качестве аккумуляторов водорода. Они представляют собой емкие и надежные хранилища. Для них открыта перспектива быть широко примененными в автомобилестроении, в качестве емкостей для хранения альтернативного топлива.
В электронике лантан используется в качестве проводника. Гексаборид лантана нашел свою применение в электронных микроскопах, это позволило значительно повысить разрешающую способность электронных микроскопных систем, повысить их ресурс.
В качестве еще одной перспективы применения химического элемента лантана современные исследователи видят его в качестве основной составляющей аккумуляторов нового типа с твердым электролитом. Эксперименты показывают, что такие источники обладают высокой удельной электроемкостью. У них длительный срок сохранения энергии без потерь. Отличаются прочностью и долговечностью. Вследствие чего они, возможно, в недалеком будущем составят серьезную конкуренцию другим аккумуляторам.
В медицине препараты, содержащие лантан, нашли применение при гиперфосфатемии. Их назначают в качестве лекарственного средства, который препятствует всасыванию фосфатов при приеме пищи.
Характерные химические реакции (adsbygoogle = window.adsbygoogle || []).push({});
Как было отмечено ранее, лантаноиды и актиноиды являются химически активными металлами. Так, лантан, церий и другие элементы семейства легко соединяются с простыми веществами – галогенами, а также с фосфором, углеродом. Лантаноиды могут также взаимодействовать как с монооксидом углерода, так и с углекислым газом. Они также способны разлагать воду. Кроме простых солей, например таких как SeCl3 или PrF3, они образуют двойные соли
В аналитической химии важное место занимают реакции металлов-лантаноидов с аминоуксусной и лимонной кислотами. Образующиеся в результате таких процессов комплексные соединения применяются для разделения смеси лантаноидов, например в рудах
При взаимодействии с нитратной, хлоридной и сульфатной кислотами, металлы образуют соответствующие соли. Они хорошо растворимы в воде и легко способны к образованию кристаллогидратов. Нужно отметить, что водные растворы солей лантаноидов окрашены, что объясняется присутствием в них соответствующих ионов. Растворы солей самария или празеодима зеленого цвета, неодима – красно-фиолетового, прометия и европия – розового. Так как ионы со степенью окисления +3 окрашены, это используется в аналитической химии для распознавания ионов металлов-лантаноидов (так называемые качественные реакции). Для этой же цели применяют еще и такие методы химического анализа, как дробная кристаллизация и ионообменная хроматография.
У актиноидов можно выделить две группы элементов. Это берклий, фермий, менделевий, нобелий, лоуренсий и уран, нептуний, плутоний, омереций. Химические свойства первой из них подобны лантану и металлам из его семейства. Элементы второй группы обладают очень похожими химическими характеристиками (практически идентичны друг другу). Все актиноиды быстро взаимодействуют с неметаллами: серой, азотом, углеродом. С кислородсодержащими легандами они образуют комплексные соединения. Как видим, металлы обоих семейств близки между собой по химическому поведению. Вот почему лантаноиды и актиноиды часто называют металлами-близнецами.
Общие способы получения металлов в промышленности
За исключением тория, протактиния и урана, которые добывают прямым путем из руд, остальные актиноиды можно получить путем облучения образцов металлического урана быстродвижущимися потоками нейтронов. В промышленных масштабах нептуний и плутоний добывают из отработанного топлива ядерных реакторов. Отметим, что получение актиноидов – это достаточно сложный и дорогостоящий процесс, основными методами которого являются ионный обмен и многостадийная экстракция. Лантаноиды, которые называют редкоземельными элементами, получают путем электролиза их хлоридов или фторидов. Чтобы добыть сверхчистые лантаноиды, используют металлотермический метод.

Как электронная конфигурация f-подуровня влияет на свойства металлов (adsbygoogle = window.adsbygoogle || []).push({});
Как мы уже говорили ранее, положение лантаноидов и актиноидов в периодической системе напрямую определяет их физические и химические характеристики. Так, ионы церия, гадолиния и других элементов семейства лантаноидов имеют высокие магнитные моменты, что связано с особенностями строения f-подуровня. Это позволило использовать металлы в качестве легирующих добавок для получения полупроводников с магнитными свойствами. Сульфиды элементов семейства актиния (например, сульфид протактиния, тория) в составе своих молекул имеют смешанный тип химической связи: ионно-ковалентный или ковалентно-металлический. Эта особенность строения привела к появлению нового физико-химического свойства и послужила ответом на вопрос о том, почему лантаноиды и актиноиды обладают люминесцентными свойствами. Например, образец актиния серебристого цвета в темноте светится голубоватым свечением. Это объясняется действием на ионы металлов электрического тока, фотонов света, под влиянием которых происходит возбуждение атомов, а электроны в них «перескакивают» на более высокие энергетические уровни и затем возвращаются на свои стационарные орбиты. Именно по этой причине лантаноиды и актиноиды относятся к люминофорам.
Распространение в природе
Оксиды актиноидов и лантаноидов часто называют циркониевой, ториевой, иттриевой землями. Они являются основным источником для получения соответствующих металлов. Уран, как главный представитель актиноидов, находится в наружном слое литосферы в форме четырёх видов руд или минералов. Прежде всего, это урановая смолка, представляющая собой двуокись урана. В ней содержание металла самое высокое. Часто диоксиду урана сопутствуют радиевые месторождения (жилы). Они встречаются в Канаде, Франции, Заире. Комплексы ториевой и урановой руды часто содержат руды других ценных металлов, например золота или серебра.

Запасами такого сырья богаты Россия, Южно-Африканская республика, Канада и Австралия. В некоторых осадочных породах содержится минерал карнотит. В его состав, кроме урана, входит еще и ванадий. Четвертый вид уранового сырья – это фосфатные руды и железоурановые сланцы. Их запасы находятся в Марокко, Швеции и США. В настоящее время перспективными считаются также залежи лигнитов и каменного угля, содержащие примеси урана. Их добывают в Испании, Чехии, а также в двух американских штатах – Северной и Южной Дакоте.
– Источник
Приложения
Каталитические компоненты используются, например, чтобы сделать сверхпроводники , редкоземельный самарий – кобальт и неодим – железо – бор магниты , катализаторы для переработки нефти , а также батареи аккумуляторов для гибридных электрических автомобилей . В катионы лантаноидов используются в качестве ионов активных материалов люминесцентного для применения оптоэлектронных , во- первых , чтобы сделать Nd: YAG лазеры . В оптических усилителях в волокне , легированные с эрбием являются важным компонентом волоконно – оптических систем связи. Фосфоресцирующие вещества на основе лантаноидов также широко используются для производства электронно-лучевых трубок , в частности для цветного телевидения . Сферы из железо-иттриевого граната ( ЖИГ ) могут использоваться в качестве регулируемых микроволновых резонаторов. Оксиды лантаноидов в смеси с вольфрамом улучшают свои термические свойства при сварке TIG , заменяя диоксид тория ThO 2., употребление которых представляет опасность для здоровья. Лантаноиды также используются во многих видах военной техники, таких как бинокли ночного видения и дальномеры . Радиолокационная система AN / SPY-1, установленная на некоторых зданиях с боевой системой Aegis и гибридными эсминцами силовой установки класса Arleigh Burke, использует редкоземельные магниты.
Лантаноиды также участвуют в таких областях, как фотокатализ («расщепление воды»), фотолюминесценция , создание современных материалов для электроники , а также в ядерной промышленности с разработкой матриц-хозяев для включения, хранения и переработки актинидов. .
Большая часть расходуемых ядов (поглотителей нейтронов), используемых в ядерных реакторах , обычно в оксидной форме, поступает из семейства лантаноидов , поскольку низкие изотопы нейтронов актинидов часто эффективны для захвата нейтронов . Это, например, случай европия , гадолиния , эрбия и диспрозия .
Общие свойства
Это блестящие металлы с серебристым блеском, которые быстро тускнеют на воздухе. По мере увеличения атомного номера они становятся все менее и менее мягкими . Их температура плавления и кипения выше, чем у большинства металлов, за исключением переходных металлов . Они бурно реагируют с большинством неметаллов и горят на воздухе. Это свойство используется в более легких камнях , которые сделаны из сплава лантаноидов, мишметалла .
Эти элементы не редкость в естественной среде, церий 58 Ce является 26- м или 27- м наиболее распространенным элементом земной коры (содержание того же порядка, что и у меди ). Неодима 60 Nd более многочисленно , чем кобальт , то лютеций 71 Л (менее обильные нерадиоактивные лантаноиды), однако, более обильный , чем серебро , и туллий более обильный , чем йод .
Лантаноиды довольно хорошо подтверждают эффект Оддо-Харкинса , согласно которому элементы с атомным номером больше 4 более распространены во Вселенной, когда их атомный номер четный, чем когда он нечетный.
Элемент Атомная масса Плавление температура Температура кипения массовый объем Атомный радиус Электронная конфигурация Энергия ионизации Электроотрицательность ( Полинг ) Ионный радиус трикации Ln 3+ Лантан 138,90547 ед. 920 ° С 3464 ° С 6,162 г · см -3 187 вечера 6s 2 5d 1 (*) 538,1 кДж · моль -1 1,10 103.2 вечера Церий 140,116 (1) ед. 795 ° С 3443 ° С 6,770 г · см -3 181,8 вечера 6s 2 4f 1 5d 1 (*) 534,4 кДж · моль -1 1,12 102 вечера Празеодим 140.90766 u 935 ° С 3 130 ° С 6,77 г · см -3 182 вечера 6s 2 4f 3 527 кДж · моль -1 1.13 99 вечера Неодим 144 242 (3) u 1,024 ° С 3074 ° С 7,01 г · см -3 181 вечера 6s 2 4f 4 533,1 кДж · моль -1 1.14 98.3 вечера Прометий 1042 ° С 3000 ° С 7,26 г · см -3 183 вечера 6s 2 4f 5 540 кДж · моль -1 1.13 97 вечера Самарий 150,36 (2) ед. 1072 ° С 1900 ° С 7,52 г · см -3 180 вечера 6s 2 4f 6 544,5 кДж · моль -1 1.17 95,8 вечера Европий 151 964 (1) ед. 826 ° С 1529 ° С 5,264 г · см -3 180 вечера 6s 2 4f 7 547,1 кДж · моль -1 1.2 94.7 вечера Гадолиний 157,25 (3) ед. 1312 ° С 3000 ° С 7,90 г · см -3 180 вечера 6s 2 4f 7 5d 1 (*) 593,4 кДж · моль -1 1,20 93.8 вечера Тербий 158.92 535 ед. 1,356 ° С 3,123 ° С 8,23 г · см -3 177 вечера 6s 2 4f 9 565,8 кДж · моль -1 1.2 92.3 вечера Диспрозий 162 500 (1) ед. 1,407 ° С 2,562 ° С 8,540 г · см -3 178 вечера 6s 2 4f 10 573,0 кДж · моль -1 1,22 91.2 вечера Гольмий 164.93033 ед. 1461 ° С 2600 ° С 8,79 г · см -3 176 вечера 6s 2 4f 11 581,0 кДж · моль -1 1,23 90,1 вечера Эрбий 167 259 (3) u 1529 ° С 2868 ° С 9,066 г · см -3 176 вечера 6s 2 4f 12 589,3 кДж · моль -1 1,24 89 вечера Тулий 168.93422 ед. 1545 ° С 1,950 ° С 9,32 г · см -3 176 вечера 6s 2 4f 13 596,7 кДж · моль -1 1,25 88 вечера Иттербий 173 045 ед. 824 ° С 1,196 ° С 6,90 г · см -3 176 вечера 6s 2 4f 14 603,4 кДж · моль -1 1.1 86,8 вечера Лютеций 174.9668 ед. 1,652 ° С 3,402 ° С 9,841 г · см -3 174 вечера 6s 2 4f 14 5d 1 523,5 кДж · моль -1 1,27 86,1 вечера
- (*) Исключения из правила Клечковского : лантан 57 La, церий 58 Ce, гадолиний 64 Gd.
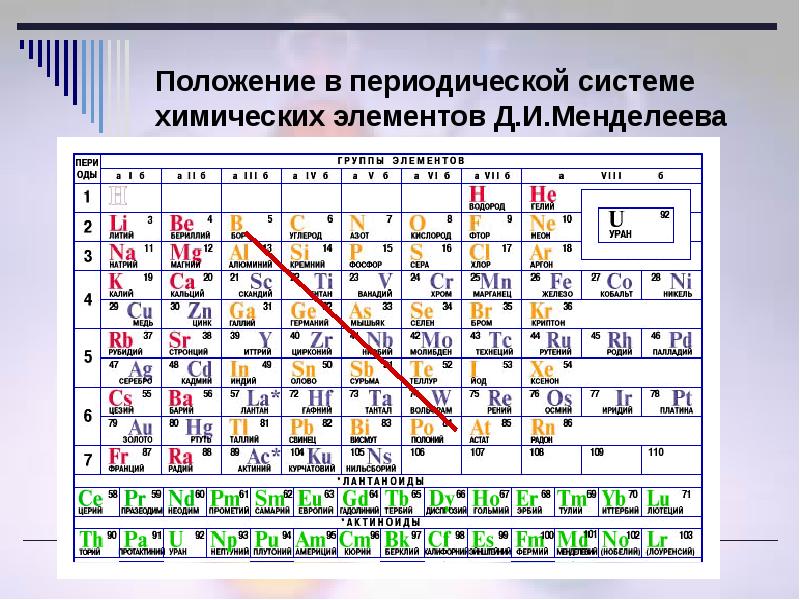
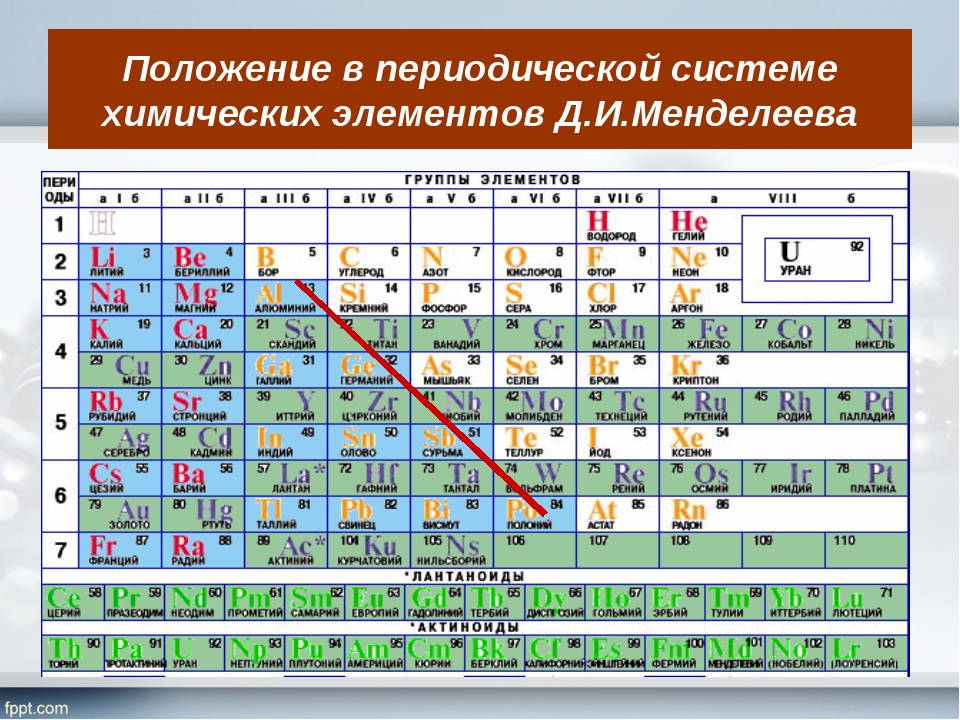
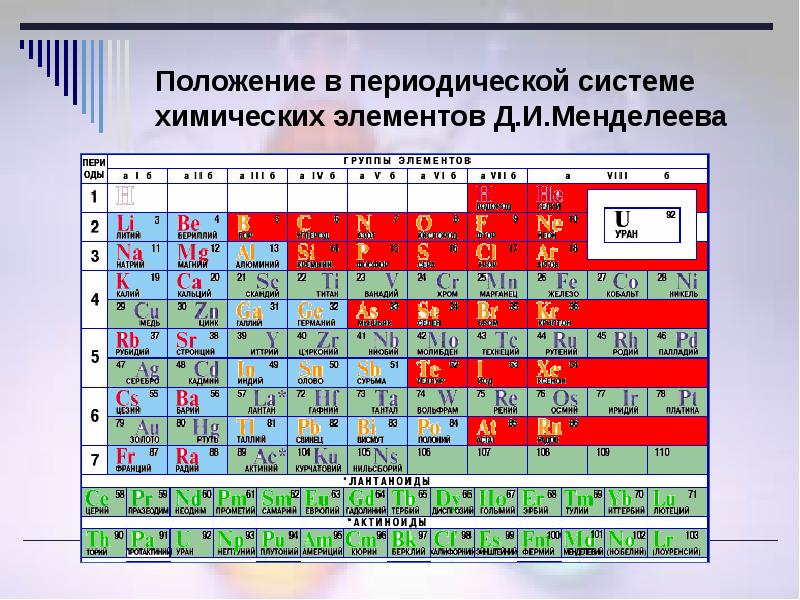
Положение в периодической системе водорода, лантаноидов, актиноидов
Нужно учитывать тот факт, что водород является достаточно реакционноспособным веществом. Он проявляет себя в зависимости от условий химической реакции: как восстановителем, так и окислителем. Именно поэтому в периодической системе водород располагается одновременно в главных подгруппах сразу двух групп.
В первой водород играет роль восстановителя, как и щелочные металлы, расположенные здесь. Место водорода в 7-й группе наряду с элементами галогенами указывает на его восстановительную способность. В шестом периоде находится, как уже ранее было сказано, семейство лантаноидов, вынесенное в отдельный ряд для удобства и компактности таблицы. Седьмой период содержит группу радиоактивных элементов, по своим характеристикам подобным актинию. Актиноиды располагаются вне таблицы химических элементов Д.И Менделеева под рядом семейства лантана. Эти элементы наименее изучены, так как ядра их атомов очень неустойчивы по причине радиоактивности. Напомним, что лантаноиды и актиноиды относятся к элементам внутренним переходным, а их физико-химические характеристики очень близки между собой.
Нахождение в природе
С точки зрения нахождения в природе лантаноиды делятся на 2 группы: цериевую ( Ce, Pr, Nd, Pm, Sm, Eu) и иттриевую ( Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu). Данный раздел основывается на том, что в одних минералах встречаются преимущественно церий и его “группа”, а в других – иттрий вместе с остальными элементами. К минералам цериевой группы относится монацит (Это, La, Nb ….) PO 4. Он образует россыпи монацитового песка, куда, кроме него, входит кварц, рутил, оксид тория. В монацитового песка содержатся все минералы цериевой группы. Элементы этой же группы содержатся в изоморфных фторокарбонатах (Это, La ….) FCO 3 (бастнезит), а также в собственном силикате Ce 2 Si 2 O 7 (церит). К минералам иттриевой группе относится ксенотим (Y, Eu, Gd, …) РО 4, в котором лантаноиды изоморфно замещают друг друга.
Второй по важности редкоземельный минерал – бастнезит – во многом похож на него. Бастнезит тоже тяжелый, тоже блестящий, тоже не постоянен по окраске (чаще всего ярко-желтый). Но химически с монацита его объединяет только большое содержание лантана и лантаноидов
Если монацит – фосфат, то бастнезит – фторокарбонат редких земель, его состав обычно записывают так: (La, Се) FCO 3. Но, как часто бывает, формула минерала не полностью отражает его состав. В данном случае она указывает лишь на главные компоненты: в бастнезити 36,9-40,5% оксида церия и почти столько же (в сумме) оксидов лантана, празеодима и неодима. Но обычно в нем есть и другие лантаноидов
Но химически с монацита его объединяет только большое содержание лантана и лантаноидов. Если монацит – фосфат, то бастнезит – фторокарбонат редких земель, его состав обычно записывают так: (La, Се) FCO 3. Но, как часто бывает, формула минерала не полностью отражает его состав. В данном случае она указывает лишь на главные компоненты: в бастнезити 36,9-40,5% оксида церия и почти столько же (в сумме) оксидов лантана, празеодима и неодима. Но обычно в нем есть и другие лантаноидов.
Есть даже селективный неодимовый минерал – ешинит. В этот минерал входят окислы кальция, тория, тантала, ниобия, иттрия, лантана и лантаноидов, из которых в нем больше церия и неодима.
Лантаноиды распространены в природе не одинаково. Наиболее труднодоступные лантаноиды – тербий, тулий, лютеций (все это лантаноиды с нечетными атомными номерами) – стоят дороже золота и платины.
Ресурсы лантанидов довольно значительны – суммарный массовое содержание лантанидов (вместе с лантаном) в земной коре 0,01%, что близко к содержанию меди. Наиболее распространенными являются La, Ce i Nd. Известно более 250 минералов, содержащих лантаниды. Из них собственных минералов лантанидов – 60-65 (содержание редких земель более 5-8%). Это главным образом фосфаты, лития или флуорокарбонаты, титанониобаты. Важнейшие минералы, содержащие лантаниды: монацит, ксенотим, бастнезит, гадолинит, ортит, лопарит, евксенит, фергусонит, самарскит. Лантаниды концентрируются в различных типах магматогенных, осадочных и метаморфогенных месторождений.
В Украину руды лантанидов не добываются. Потребности страны (ок. 100 т / год) покрывает импорт. Промышленные концентрации лантанидов обнаружены в юго-восточной и юго-западной частях Украинского щита.
Литература
|
Физические свойства
Температура плавления лантаноидов в целом увеличивается от лантана ( 920 ° C ) до лютеция ( 1652 ° C ). Считается , что в зависимости от степени гибридизации между орбитальным 6s, 4f и 5d. Эта гибридизация будет максимальной на уровне церия, который с электронной конфигурацией 6s 2 4f 1 5d 1 имеет самую низкую температуру плавления в семействе ( 795 ° C ).
Металлические свойства
Европия , с электронной конфигурацией 6s 2 4f 7 характеризуется подслоем 4f наполовину, отличаются своей плотностью значительно ниже ( 5,264 г · см -3 ) , чем все другие лантаноиды, и его выше металлического радиусом ( 208,4 мкм ), чем у всех других лантаноидов. Его можно сравнить с барием , у которого радиус металла 222 мкм . Считается, что металлический европий образуется из ионов Eu 2+ , каждый из которых отправляет только два электрона через зону проводимости . Иттербия , с электронной конфигурацией 6s 2 4f 14 характеризуется подслоем 4f насыщенными, также имеет большой радиус проволоку, а сам по себе также формируется в металлическом состоянии, катионы Yb 2+ отправка каждых два электрона в зона проводимости.
Сопротивление металлических лантаноидов является относительно высокой, в пределах от 29 до 134 мкОм · см ; для сравнения, хороший электрический проводник, такой как алюминий, имеет удельное сопротивление 2,655 мкОм · см .
Магнитные и спектроскопические свойства
Лантаноиды парамагнитны , за исключением лантана, иттербия и лютеция, у которых нет ни одного электрона. Это приводит к высокой магнитной восприимчивости для этих элементов. Гадолиния является ферромагнитным ниже 16 ° C ( точки Кюри ), в то время как более тяжелые лантаноиды ( тербия , диспрозия , гольмия , эрбия , тулия и иттербия ) становятся ферромагнитного друг на гораздо более низкой температуре.
За исключением лантана и лютеция , все трехвалентные катионы Ln 3+ имеют неспаренных электронов в подслоя 4f. Однако их магнитный момент значительно отличается от их значения, полученного только из спина , из-за сильной спин-орбитальной связи . Максимальное число одиночных электронов достигается с Б – жьей 3+ иона , чей магнитный момент равен 7,94 МБ в то время как высокие магнитные моменты ( 10.4-10.7 М.Б. ) наблюдаются для ионов. Dy 3+ и Ho 3+
Однако все электроны Gd 3+ имеют параллельный спин, что важно при использовании гадолиния в качестве контрастного вещества при магнитно-резонансной томографии
Высвобождение вырождения 4f-орбиталей в ионах лантаноидов довольно мало, с более узким распределением уровней энергии, чем спин-орбитальное взаимодействие. Переходы между 4f орбиталями запрещены правилом Ляпорта (in) . Кроме того, поскольку эти орбитали относительно внутри атома, они слабо связаны с колебаниями молекул. Поэтому спектр ионов лантаноидов довольно слабый, и их полосы поглощения также узкие. Стекла, содержащие оксид гольмия (III) Ho 2 O 3и растворы оксида гольмия (III) (обычно в хлорной кислоте HClO 4) Демонстрируют интенсивные пики поглощения в спектральном диапазоне от 200 до 900 нм : они являются коммерчески доступными и могут быть использованы для калибровки из спектроскопов и монохроматоров .
Поскольку переходы f → f запрещены, релаксация возбужденного электрона в основное состояние происходит довольно медленно. Это делает лантаноиды интересными для создания лазеров, потому что в этом случае инверсия населенностей легко достижима. Nd: YAG – лазер , или иттрий-алюминиевый гранат Y 3 Al 5 O 12( YAG ), легированный неодимом , является очень распространенным типом лазеров. Иттрия ванадат YVO 4легированный европием был одним из первых фосфоресцирующих веществ, использованных для изготовления цветных электронно-лучевых трубок . Замечательные люминесцентные свойства лантаноидов обусловлены их 4f-орбиталями.