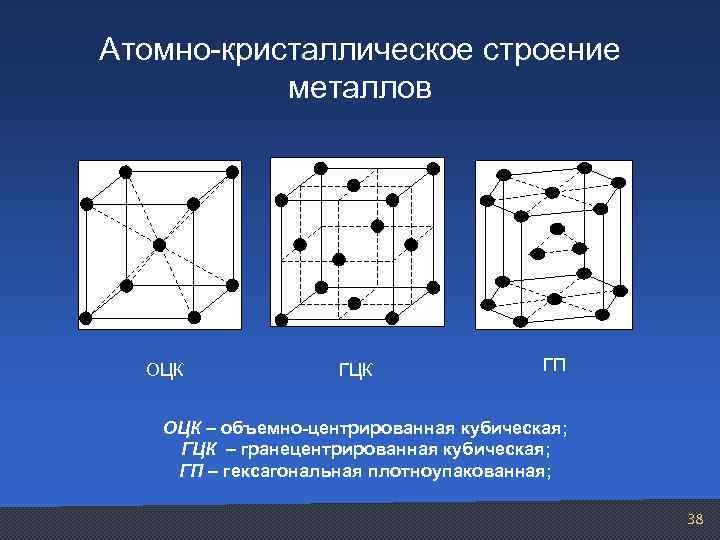
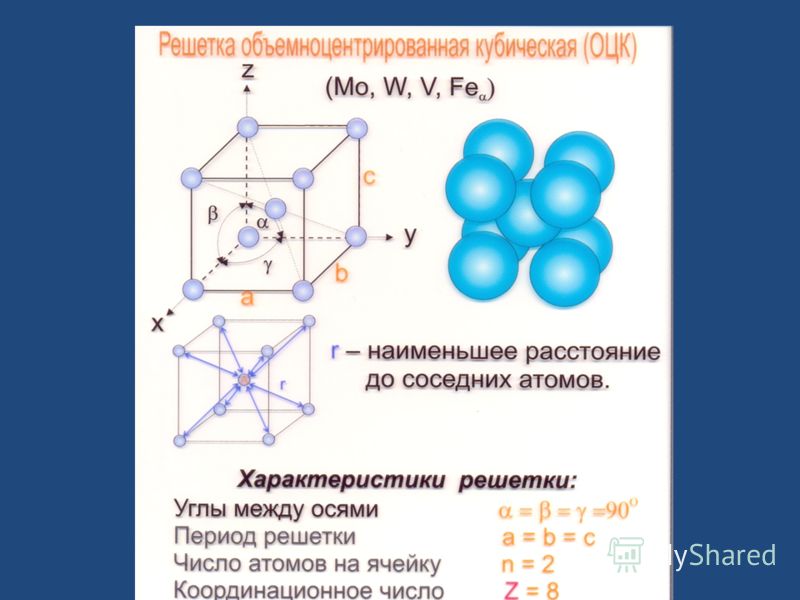
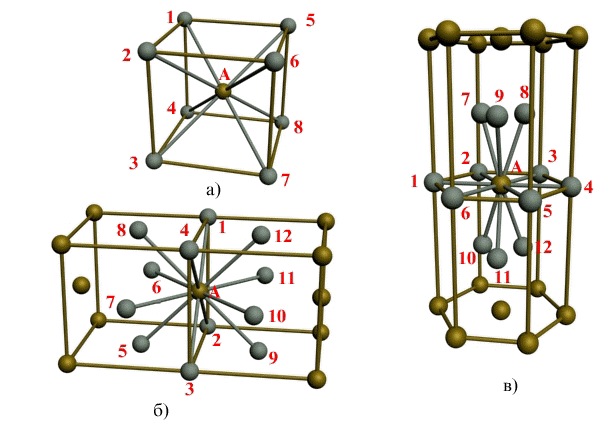Атомно-кристаллическое строение металлов
В чем же заключается такое строение, чем характеризуется? Само название говорит о том, что все металлы представляют собой кристаллы в твердом состоянии, то есть при обычных условиях (кроме ртути, которая является жидкостью). А что такое кристалл?
Это условное графическое изображение, построенное путем пересечения воображаемых линий через атомы, которые выстраивают тело. Другими словами, каждый металл состоит из атомов. Они располагаются в нем не хаотично, а очень правильно и последовательно. Так вот, если мысленно соединить все эти частицы в одну структуру, то получится красивое изображение в виде правильного геометрического тела какой-либо формы.
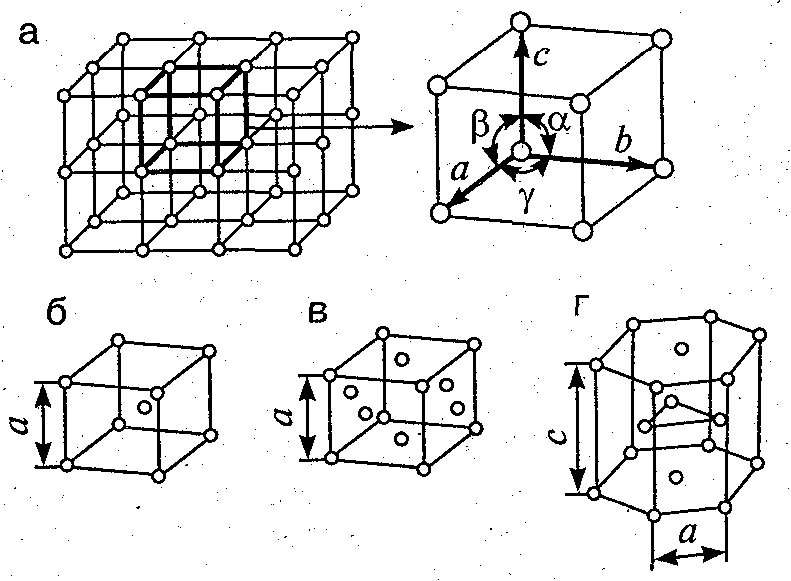
Это и принято называть кристаллической решеткой металла. Она очень сложная и пространственно объемная, поэтому для упрощения показывают не всю ее, а лишь часть, элементарную ячейку. Совокупность таких ячеек, собранная вместе и отраженная в трехмерном пространстве, и образует кристаллические решетки. Химия, физика и металловедение — это науки, которые занимаются изучением особенностей строения таких структур.
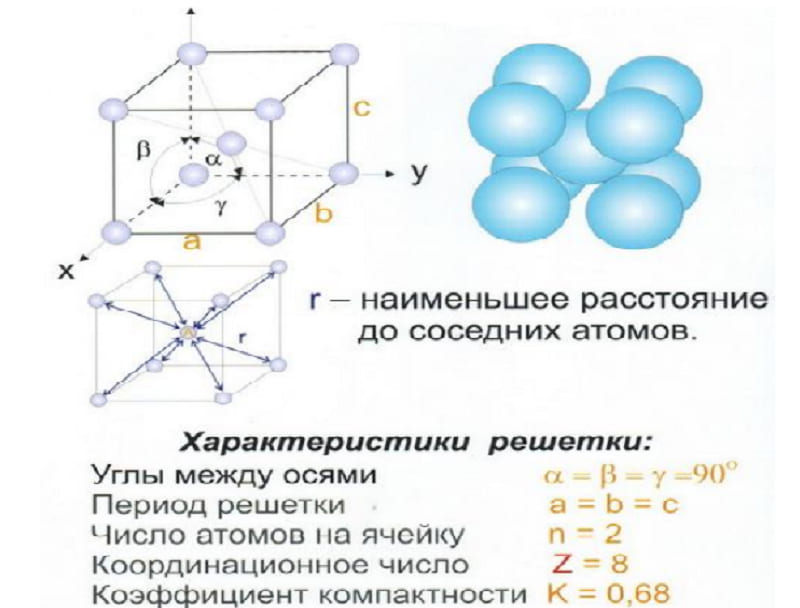
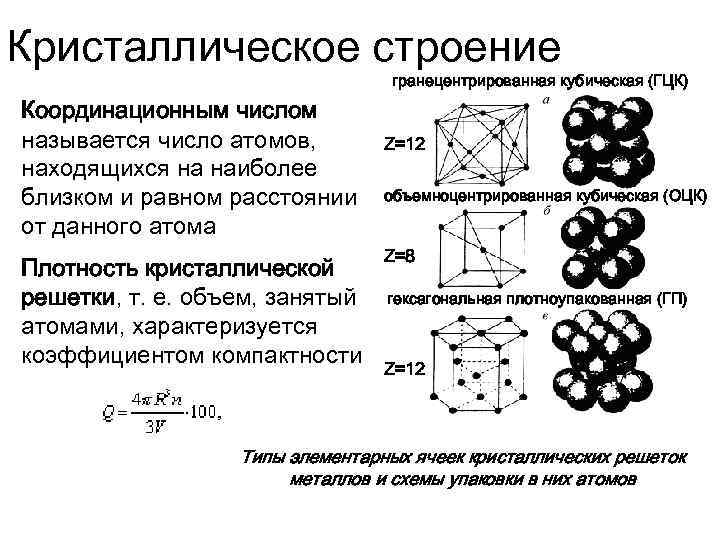
Сама элементарная ячейка — это набор атомов, которые располагаются на определенном расстоянии друг от друга и координируют вокруг себя строго фиксированное число других частиц. Она характеризуется плотностью упаковки, расстоянием между составными структурами, координационным числом. В целом все эти параметры являются характеристикой и всего кристалла, а значит, отражают и проявляемые металлом свойства.
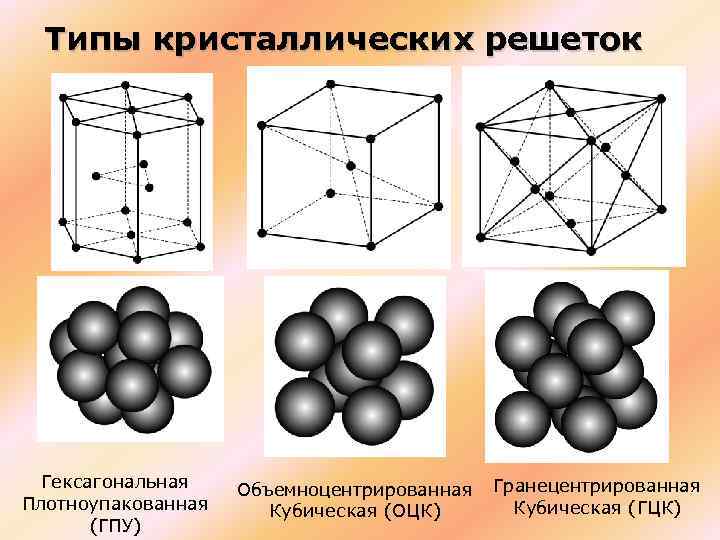
Существует несколько разновидностей кристаллических решеток. Объединяет их все одна особенность — в узлах находятся атомы, а внутри располагается облако электронного газа, которое формируется путем свободного передвижения электронов внутри кристалла.
1.1. Аморфныеи кристаллические тела
В твердыхтелах атомы могут размещаться впространстве двумя способами:
Беспорядочное расположение атомов, когда они не занимают определенного места друг относительно друга. Такие тела называются аморфными.
Аморфныевещества обладают формальными признакамитвердых тел, т.е. они способны сохранятьпостоянный объем и форму. Однако они неимеют определенной температуры плавленияили кристаллизации.
Упорядоченное расположение атомов, когда атомы занимают в пространстве вполне определенные места, Такие вещества называются кристаллическими.
Атомы совершаютотносительно своего среднего положенияколебания с частотой около 1013 Гц. Амплитуда этих колебанийпропорциональна температуре.
Благодаряупорядоченному расположению атомов в пространстве,их центры можно соединить воображаемымипрямыми линиями. Совокупность такихпересекающихся линий представляетпространственную решетку, которую называюткристаллической решеткой.
Внешниеэлектронные орбиты атомов соприкасаются,так что плотность упаковки атомов вкристаллической решетке весьма велика.
Кристаллическиетвердые тела состоят из кристаллическихзерен — кристаллитов. В соседних зернахкристаллические решетки повернутыотносительно друг друга на некоторый угол.
В кристаллитахсоблюдаются ближний и дальний порядки. Этоозначает наличие упорядоченногорасположения и стабильности как окружающихданный атом ближайших его соседей (ближнийпорядок), так и атомов, находящихся отнего на значительных расстояниях вплоть дограниц зерен (дальний порядок).
а) б)
Рис. 1.1. Расположениеатомов в кристаллическом (а) и аморфном (б)веществе
Вследствие диффузии отдельные атомымогут покидать свои места в узлахкристаллической решетки, однако при этомупорядоченность кристаллического строенияв целом не нарушается.
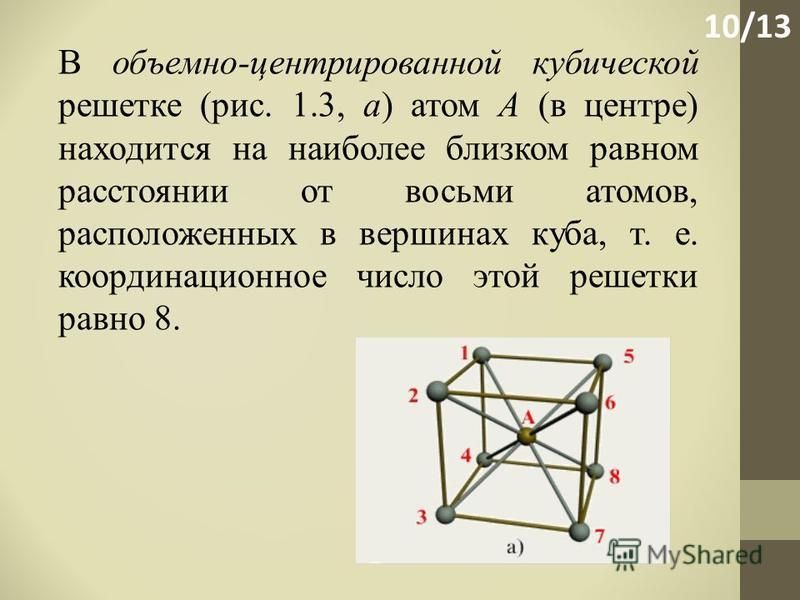
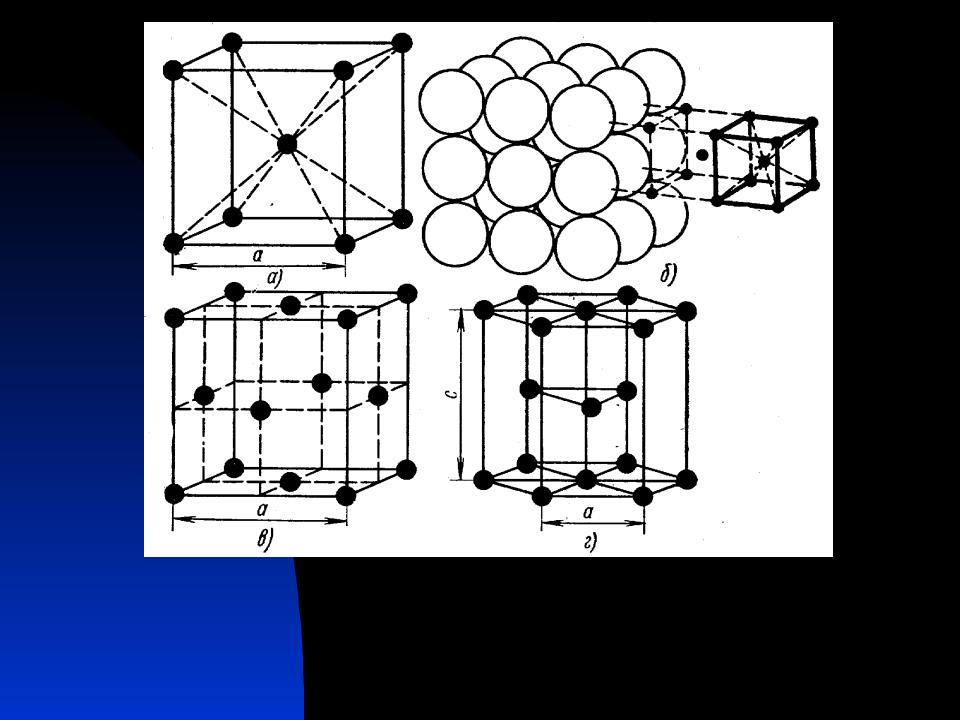
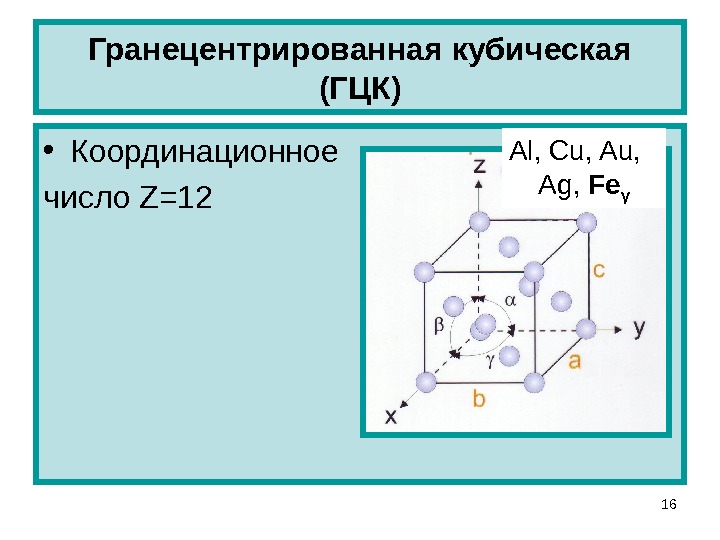
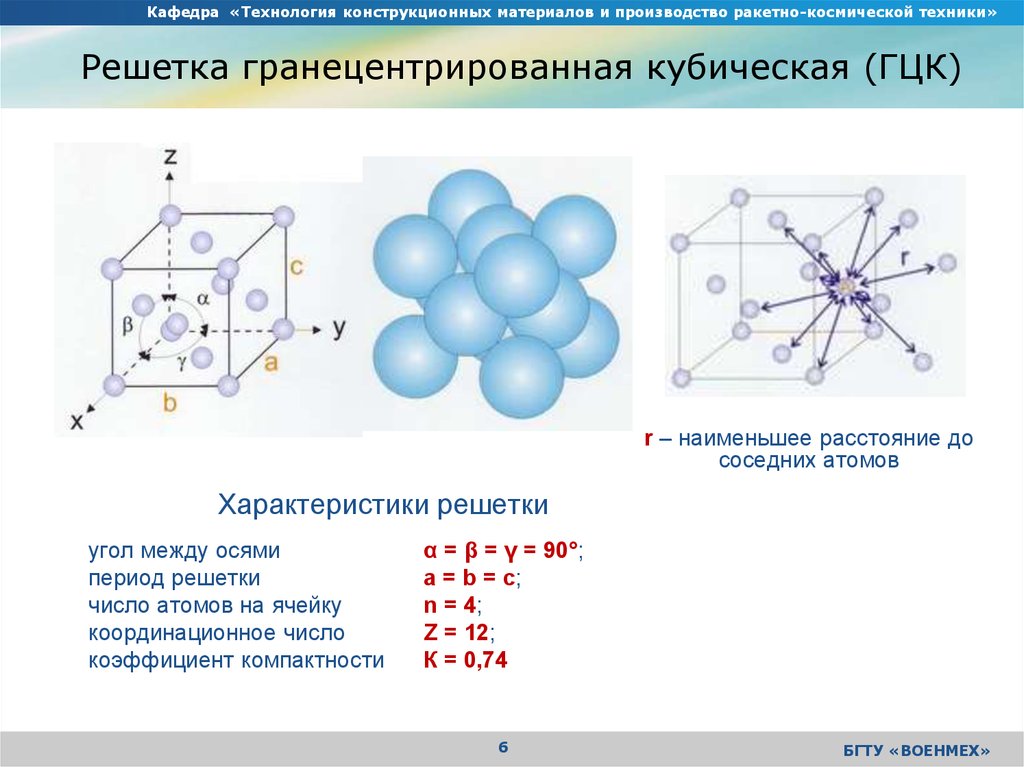
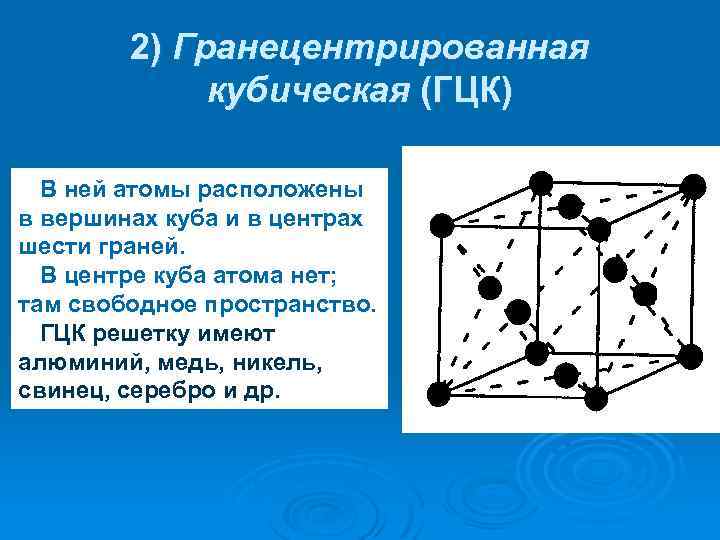
Кубическая гранецентрированная решетка
Серебро имеет кубическую гранецентрированную решетку и не претерпевает аллотропических превращений. Чистое серебро применяют в химической промышленности. Структура сварных соединений серебра не отличается какими-либо специфическими особенностями.
Если в кубической гранецентрированной решетке картина сравнительно проста, то в гексагональной плотно упакованной ( см. рис. 7.8) в верхнем и нижнем основаниях ячейки лежат равносторонние шестиугольники, в вершинах которых расположены атомы. В центрах оснований тоже расположено по одному атому. Кроме того, три атома расположены внутри ячейки. Если взять равносторонний треугольник ОВС, восставить в точке пересечения его медиан нормаль к плоскости ОВС и отложить отрезок cd между основаниями, то один из внутренних атомов найдем в средней точке этого отрезка.
В элементарной ячейке кубической гранецентрированной решетки содержатся четыре частицы.
| Диаграмма состояний Мп — Си. |
Кинетика превращения метастабильнои кубической гранецентрированной решетки в тетрагональную ук — Тт имеет мартенситный и обратимый характер.
Атомы Fe образуют кубическую гранецентрированную решетку, а атомы S — восемь примитивных решеток. Структура пирита родственна структуре хлорида натрия. Это становится очевидным, если рассматривать два атома S как целое.
Двуокись урана имеет кубическую гранецентрированную решетку; теоретическая плотность UO2 составляет 10 95 Мг / м3, а температура плавления 28051 15 С. Насыпная плотность двуокиси урана во многом определяется способами ее получения. Плотность двуокиси урана зависит также от содержания в ней кислорода; с ростом отношения кислорода к урану до 2 2 плотность увеличивается, а затем резко снижается.
Металлический алюминий имеет кубическую гранецентрированную решетку.
| Кристаллы со структурой хлористого цезия. |
Алмаз кристаллизуется в кубической гранецентрированной решетке. Базис решетки содержит два атома углерода.
Вещество кристаллизуется в кубической гранецентрированной решетке. Природа этого соединения еще не выяснена.
Вещество кристаллизуется в кубической гранецентрированной решетке. Природа этого соединения еще яе выяснена. Вода разлагает его по уравнению.
Вещество кристаллизуется в кубической гранецентрированной решетке. Природа этого соединения еще не выяснена.
Торий кристаллизуется в кубической гранецентрированной решетке — а-форме, устойчивой до 1400 С, при более высоких температурах он переходит в 3-форму — объемноцентрированный куб.
С-60 при кристаллизации образуют кубическую гранецентрированную решетку.
Наличие порядка в расположении частиц
В аморфном веществе, в отличие от кристаллического, отсутствует какой-либо порядок в расположении частиц. Если же в кристаллическом веществе мысленно соединить прямой два близкоросположенных друг к другу атома, то можно обнаружить, что на этой линии на строго определенных промежутках будут лежать одни и те же частицы:
Таким образом, в случае кристаллических веществах можно говорить о таком понятии, как кристаллическая решетка.
Кристаллической решеткой называют пространственный каркас, соединяющий точки пространства, в которых находятся частицы, образующие кристалл.
Точки пространства, в которых находятся образующие кристалл частицы, называют узлами кристаллической решетки.
В зависимости от того, какие частицы находятся в узлах кристаллической решетки, различают: молекулярную, атомную, ионную и металлическую кристаллические решетки.
В узлах молекулярной кристаллической решетки Кристаллическая решетка льда Кристаллическая решетка льда как пример молекулярной решетки
находятся молекулы, внутри которых атомы связаны прочными ковалентными связями, однако сами молекулы удерживаются друг возле друга слабыми межмолекулярными силами. Вследствие таких слабых межмолекулярных взаимодействий кристаллы с молекулярной решеткой являются непрочными. Такие вещества от веществ с иными типами строения отличаются существенно более низкими температурами плавления и кипения, не проводят электрический ток, могут как растворяться, так и не растворяться в различных растворителях.
Растворы таких соединений могут как проводить, так и не проводить электрический ток в зависимости от класса соединения. К соединениям с молекулярной кристаллической решеткой относятся многие простые вещества — неметаллы (отвержденные H2, O2, Cl2, ромбическая сера S8, белый фосфор P4), а также многие сложные вещества – водородные соединения неметаллов, кислоты, оксиды неметаллов, большинство органических веществ. Следует отметить, что, если вещество находится в газообразном или жидком состоянии, говорить о молекулярной кристаллической решетке неуместно: корректнее использовать термин — молекулярный тип строения.
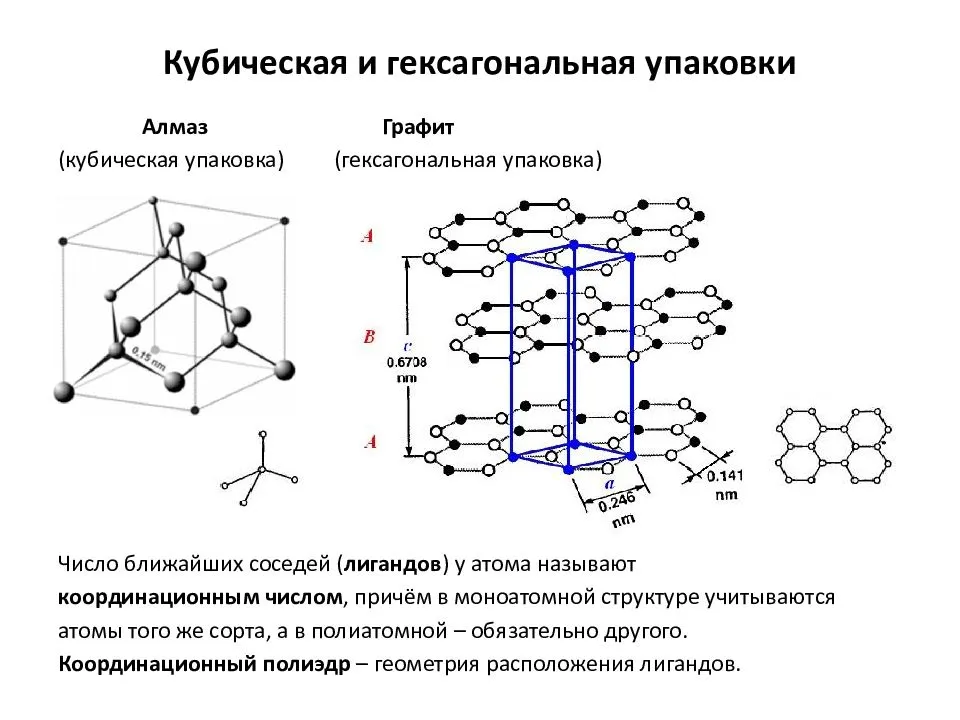
кристаллическая решетка алмаза Кристаллическая решетка алмаза как пример атомной решетки В узлах атомной кристаллической решетки
находятся атомы. При этом все узлы такой кристаллической решетки «сшиты» между собой посредством прочных ковалентных связей в единый кристалл. Фактически, такой кристалл является одной гигантской молекулой. Вследствие особенностей строения все вещества с атомной кристаллической решеткой являются твердыми, обладают высокими температурами плавления, химически мало активны, не растворимы ни в воде, ни в органических растворителях, а их расплавы не проводят электрический ток. Следует запомнить, что к веществам с атомным типом строения из простых веществ относятся бор B, углерод C (алмаз и графит), кремний Si, из сложных веществ — диоксид кремния SiO2 (кварц), карбид кремния SiC, нитрид бора BN.
У веществ с ионной кристаллической решеткой в узлах решетки находятся ионы, связанные друг с другом посредством ионных связей.
Поскольку ионные связи достаточно прочны, вещества с ионной решеткой обладают сравнительно высокой твердостью и тугоплавкостью. Чаще всего они растворимы в воде, а их растворы, как и расплавы проводят электрический ток. К веществам с ионным типом кристаллической решетки относятся соли металлов и аммония (NH4+), основания, оксиды металлов. Верным признаком ионного строения вещества является наличие в его составе одновременно атомов типичного металла и неметалла.
Кристаллическая решетка хлорида натрия
Кристаллическая решетка хлорида натрия как пример ионной решетки Однако следует отметить, что в веществах с ионным типом строения нередко можно обнаружить, помимо ионных, также ковалентные полярные связи. Это наблюдается в случае сложных ионов, т.е. состоящих из двух или более химических элементов (SO42-, NH4+, PO43- и т.д.). Внутри таких сложных ионов атомы связаны друг с другом ковалентными связями.
Металлическая кристаллическая решетка
наблюдается в кристаллах свободных металлов, например, натрия Na, железа Fe, магния Mg и т.д. В случае металлической кристаллической решетки, в ее узлах находятся катионы и атомы металлов, между которыми движутся электроны. При этом движущиеся электроны периодически присоединяются к катионам, таким образом нейтрализуя их заряд, а отдельные нейтральные атомы металлов взамен «отпускают» часть своих электронов, превращаясь, в свою очередь, в катионы. Фактически, «свободные» электроны принадлежат не отдельным атомам, а всему кристаллу.
Пустоты в элементарной ячейке
Визуализация кубической элементарной ячейки алмаза: 1. Компоненты элементарной ячейки, 2. Одна элементарная ячейка, 3. Решетка из 3 x 3 x 3 элементарных ячеек.
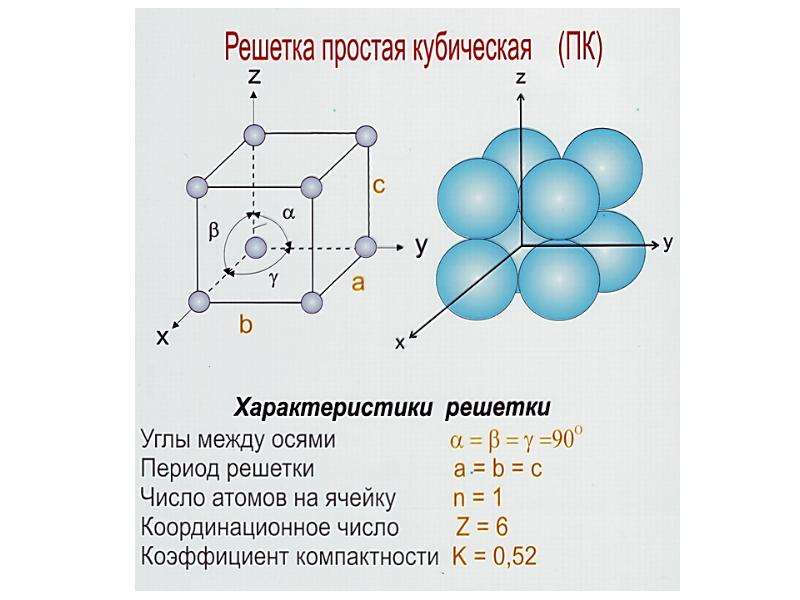
Простая кубическая элементарная ячейка имеет одну кубическую пустоту в центре.
Объемно-центрированная кубическая элементарная ячейка имеет шесть октаэдрических пустот, расположенных в центре каждой грани элементарной ячейки, и двенадцать дополнительных, расположенных в середине каждого края той же ячейки, в общей сложности шесть октаэдрических пустот. Кроме того, есть 24 тетраэдрических пустоты, расположенных на квадратном расстоянии вокруг каждой октаэдрической пустоты, в общей сложности двенадцать чистых тетраэдрических пустот. Эти тетраэдрические пустоты не являются локальными максимумами и технически не являются пустотами, но иногда они появляются в многоатомных элементарных ячейках.
Гранецентрированная кубическая элементарная ячейка имеет восемь тетраэдрических пустот, расположенных на полпути между каждым углом и центром элементарной ячейки, всего восемь чистых тетраэдрических пустот. Кроме того, имеется двенадцать октаэдрических пустот, расположенных в средних точках краев элементарной ячейки, а также одно октаэдрическое отверстие в самом центре ячейки, всего четыре чистых октаэдрических пустот.
Одной из важных характеристик кристаллической структуры является фактор упаковки атомов . Это рассчитывается исходя из предположения, что все атомы являются идентичными сферами, с радиусом, достаточно большим, чтобы каждая сфера упиралась в следующую. Фактор упаковки атомов – это доля пространства, заполненного этими сферами.
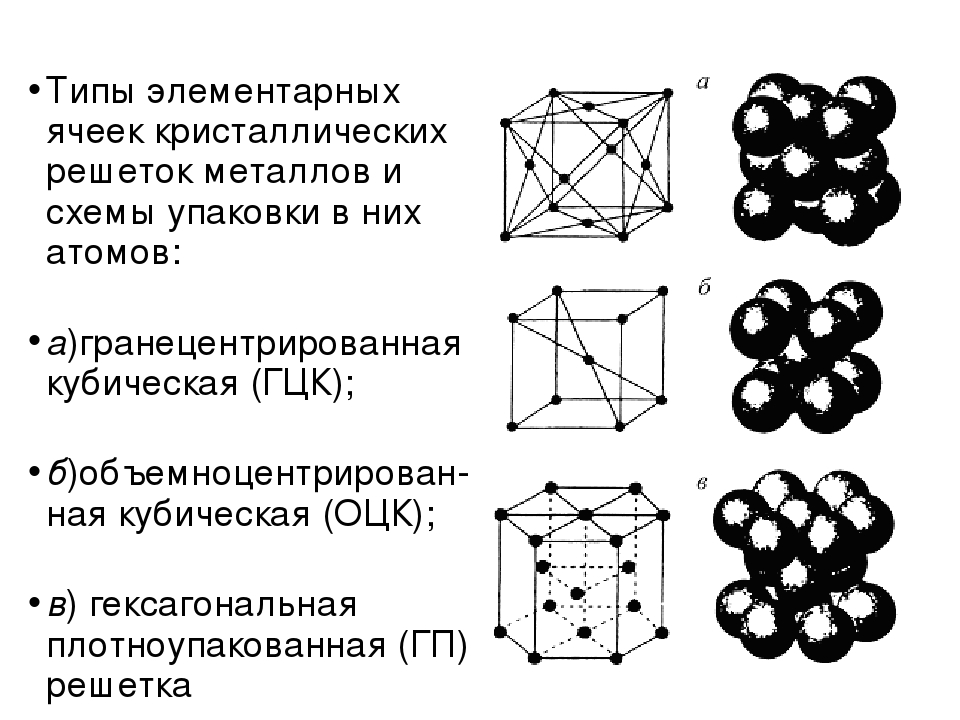
Предполагая , один атом за решетку точки, в примитивной кубической решетке с длиной стороны кубы а , радиус шара будет 2 и атомный фактор упаковки оказывается около 0,524 (что является довольно низким). Точно так же в ОЦК решетке фактор упаковки атомов составляет 0,680, а в ГЦК – 0,740. Значение ГЦК является наивысшим теоретически возможным значением для любой решетки, хотя есть и другие решетки, которые также достигают того же значения, например гексагональная плотноупакованная ( ГПУ ) и одна версия тетраэдрической ОЦК .
Как правило, поскольку атомы в твердом теле притягиваются друг к другу, более плотно упакованные атомы имеют тенденцию быть более распространенными. (Хотя могут иметь место неплотно упакованные структуры, например, если орбитальная гибридизация требует определенных валентных углов .) Соответственно, примитивная кубическая структура с особенно низким коэффициентом упаковки атомов встречается редко в природе, но встречается в полонии . ОЦК и ГЦК , с их более высокой плотностью, оба довольно широко распространены в природе. Примеры ОЦК включают железо , хром , вольфрам и ниобий . Примеры ГЦК включают алюминий , медь , золото и серебро .
Кристаллические классы [ править ]
В изометрических кристаллической системе имена классов, группы точек (в символах шёнфлиса , Германн-Моген обозначениях , орбиобразию и Кокстер обозначениях ), тип, примеры, Международные Столы для ряда пространственной группы кристаллографии, и пространственные группы , перечислены в таблице ниже . Всего существует 36 кубических пространственных групп.
| # | Группа точек | Тип | Пример | Космические группы | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Имя | Schön. | Intl | Сфера. | Кокс. | Примитивный | По центру лица | По центру тела | |||
| 195–197 | Тетартоидный | Т | 23 | 332 | + | энантиоморфный | Ульманнит , хлорат натрия | P23 | F23 | I23 |
| 198–199 | P2 1 3 | I2 1 3 | ||||||||
| 200–204 | Диплоидный | Т ч | 2 / м 3 (м 3 ) | 3 * 2 | центросимметричный | Пирит | Pm 3 , Pn 3 | Fm 3 , Fd 3 | Я 3 | |
| 205–206 | Па 3 | Ia 3 | ||||||||
| 207–211 | Гироидальный | О | 432 | 432 | + | энантиоморфный | Petzite | П432 , П4 2 32 | F432, F4 1 32 | I432 |
| 212–214 | Л4 3 32, Л4 1 32 | I4 1 32 | ||||||||
| 215–217 | Шестигранный | Т д | 4 3 мес. | * 332 | Сфалерит | P 4 3м | Ж 4 3 мес. | Я 4 3 мес. | ||
| 218–220 | П 4 3н | F 4 3c | Я 4 3d | |||||||
| 221–230 | Гексоктаэдрический | О ч | 4 / м 3 2 / м (м 3 м) | * 432 | центросимметричный | Галена , Галит | Pm 3 м, Pn 3 n, Pm 3 n , Pn 3 м | Fm 3 m , Fm 3 c, Fd 3 m, Fd 3 c | Im 3 м, Ia 3 д |
Другие термины для гексоктаэдра: нормальный класс, голоэдрический , дитессеральный центральный класс, тип галенита .
Полиморфизм
Кварц – одна из нескольких кристаллических форм кремнезема SiO 2 . Наиболее важные формы кремнезема включают: α-кварц , β-кварц , тридимит , кристобалит , коэсит и стишовит .
Полиморфизм – это появление нескольких кристаллических форм материала. Он содержится во многих кристаллических материалах, включая полимеры , минералы и металлы . Согласно правилам фазового равновесия Гиббса, эти уникальные кристаллические фазы зависят от интенсивных переменных, таких как давление и температура. Полиморфизм связан с аллотропией , которая относится к элементарным твердым телам . Полная морфология материала описывается полиморфизмом и другими переменными, такими как габитус кристаллов , аморфная фракция или кристаллографические дефекты . Полиморфы обладают разной стабильностью и могут спонтанно и необратимо превращаться из метастабильной формы (или термодинамически нестабильной формы) в стабильную форму при определенной температуре. Они также имеют разные температуры плавления , растворимость и дифрактограммы рентгеновских лучей .
Хорошим примером этого является кварцевая форма диоксида кремния или SiO 2 . В подавляющем большинстве силикатов атом Si имеет тетраэдрическую координацию по 4 атомам кислорода. Все кристаллические формы, кроме одной, включают тетраэдрические звенья {SiO 4 }, связанные вместе общими вершинами в разном расположении. В разных минералах тетраэдры демонстрируют разную степень сетки и полимеризации. Например, они встречаются поодиночке, соединены вместе попарно, в более крупные конечные кластеры, включая кольца, цепочки, двойные цепи, листы и трехмерные каркасы. Минералы классифицируются на группы на основе этих структур. В каждой из 7 термодинамически стабильных кристаллических форм или полиморфов кристаллического кварца только 2 из 4 ребер тетраэдров {SiO 4 } являются общими с другими, что дает чистую химическую формулу кремнезема: SiO 2 .
Другой пример – элементарное олово (Sn), которое является пластичным при температурах окружающей среды, но хрупким при охлаждении. Это изменение механических свойств связано с существованием двух его основных аллотропов , α- и β-олова. Два аллотропа , встречающиеся при нормальном давлении и температуре, α-олово и β-олово, более известны как серое олово и белое олово соответственно. Еще два аллотропа, γ и σ, существуют при температурах выше 161 ° C и давлениях выше нескольких ГПа. Белое олово является металлическим и представляет собой стабильную кристаллическую форму при комнатной температуре или выше. При температуре ниже 13,2 ° C олово существует в серой форме, имеющей кубическую кристаллическую структуру алмаза , подобную алмазу , кремнию или германию . Серое олово вообще не имеет металлических свойств, представляет собой тускло-серый порошкообразный материал и имеет несколько применений, кроме нескольких специализированных полупроводниковых применений. Хотя температура α – β превращения олова номинально составляет 13,2 ° C, примеси (например, Al, Zn и т. Д.) Понижают температуру перехода значительно ниже 0 ° C, и при добавлении Sb или Bi превращение может вообще не происходить.
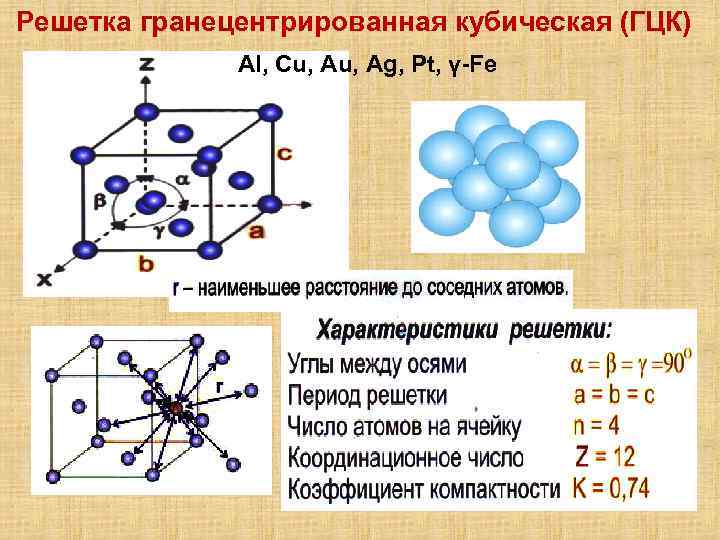
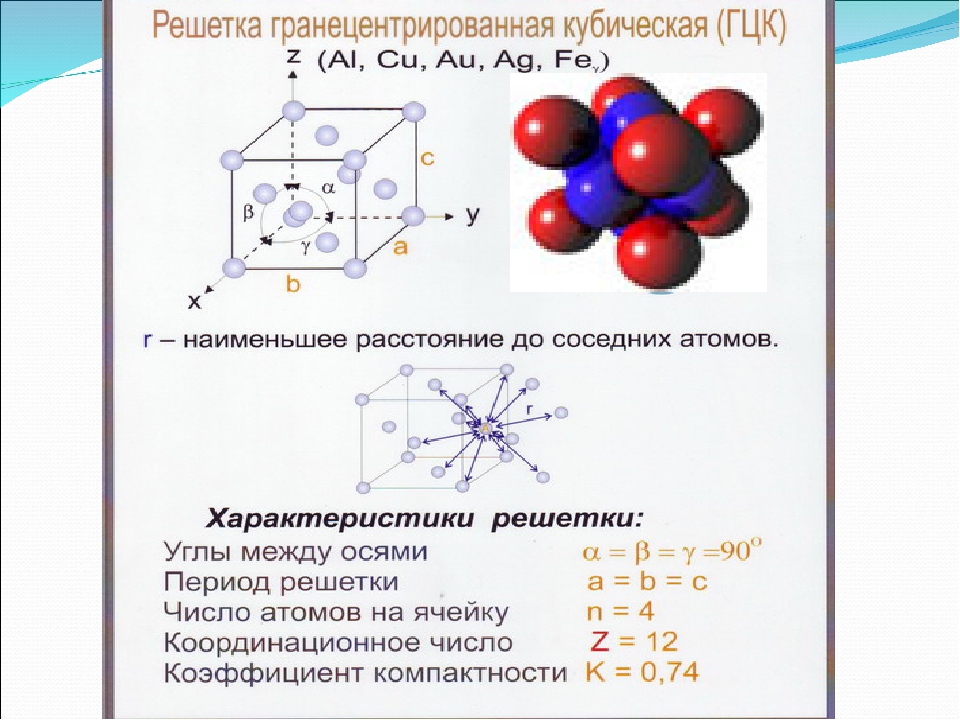
Гранецентрированная кубическая решетка
Кристаллизуется в гранецентрированной кубической решетке. Обладает высокой электрической проводностью и теплопроводностью, исключительно пластичен.
Кристаллизуется в гранецентрированной кубической решетке. Обладает высокой электрической проводимостью и теплопроводностью, исключительно пластичен.
Например, гранецентрированной кубической решетке принадлежат только четыре атома, а не 14, как может показаться на первый взгляд.
Металлы с гранецентрированной кубической решеткой ( медь, никель, алюминий, аустенитные стали с высоким содержанием никеля) сохраняют свою пластичность при температуре жидкого кислорода. Металлы с объемно центрированной решеткой ( углеродистые стали, магний, вольфрам и др.) становятся в этих условиях хрупкими.
Металлы с гранецентрированной кубической решеткой ( медь, алюминий, никель, свинец, — железо, аустенитные стали) с понижением температуры сохраняют пластичность, у них увеличиваются пределы текучести и прочности, повышается твердость и уменьшается ударная вязкость. Металлы с объемноцентрированной кубической решеткой ( а-железо, вольфрам, магний, цинк, феррит-ные стали, чугун и др.) при низких температурах становятся хрупкими.
Металлы с гранецентрированной кубической решеткой ( медь, никель, алюминий, аустенитные стали с высоким содержанием никеля) сохраняют свою пластичность при температуре жидкого кислорода. Металлы с объемно-центрированной решеткой ( углеродистые стали, магний, вольфрам и др.) становятся в этих условиях хрупкими.
Медь обладает гранецентрированной кубической решеткой. Это металл красного ( в изломе розового) цвета, ковкий и мягкий; плотность 8960 кг / м3, / пл 1083 С. Химически она малоактивна; в атмосфере, содержащей СО2, пары Н2О и др., покрывается патиной.
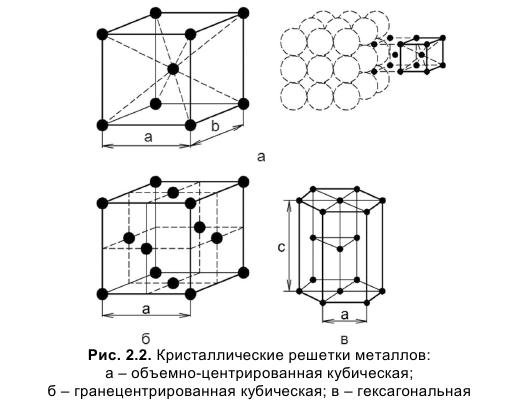
| Кристаллические решетки металлов. а — объемно-центрированная ( ОЦК. б — гранецентрированная ( ГЦК. в — гексагональная ( ГПУ. — ребро куба. — диагональ грани куба. — диагональ куба. — ось симметрии призмы. |
На элементарную ячейку гранецентрированной кубической решетки приходится четыре атома; из них один ( по такому же расчету, как и для объемно центрированной решетки) вносят атомы в вершинах куба, а три суммарно ( 1 / 2×6 3) вносят атомы, находящиеся на середине грани, так как каждый из таких атомов принадлежит двум решеткам.
Если в узлах гранецентрированной кубической решетки поместить шары, то какая доля пространства будет заполнена шарами в случае плотной упаковки. Эта доля называется коэффициентом упаковки.
| Кристаллические решетки металлов. а — объемно-центрированная ( ОЦК. б — гранецешрированная ( ГЦК. в — гексагональная ( ПТУ. — ребро куба. — диагональ грани куба. — диагональ куба. — ось симметрии призмы. |
На элементарную ячейку гранецентрированной кубической решетки приходится четыре атома; из них один ( по такому же расчету, как и для объемно центрированной решетки) вносят атомы в вершинах куба, а три суммарно ( 1 / 2×6 3) вносят атомы, находящиеся на середине грани, так как каждый из таких атомов принадлежит двум решеткам.
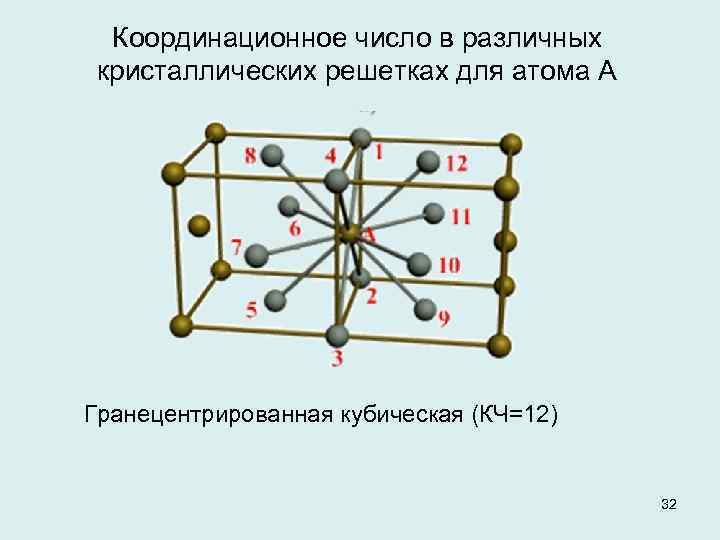
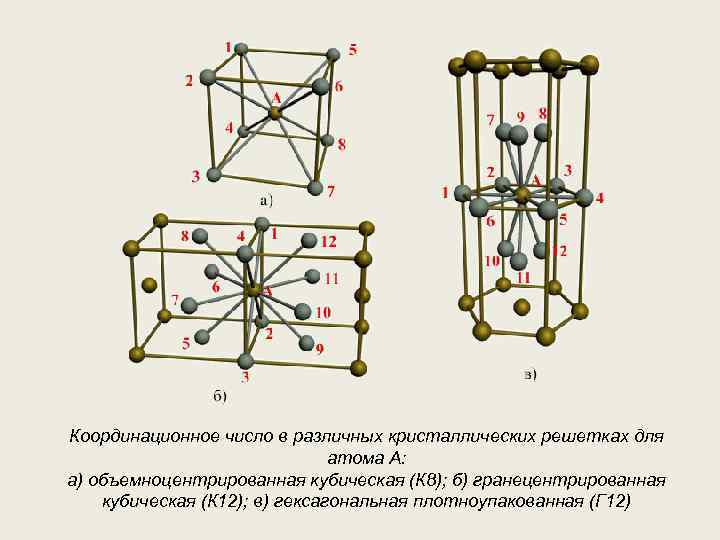
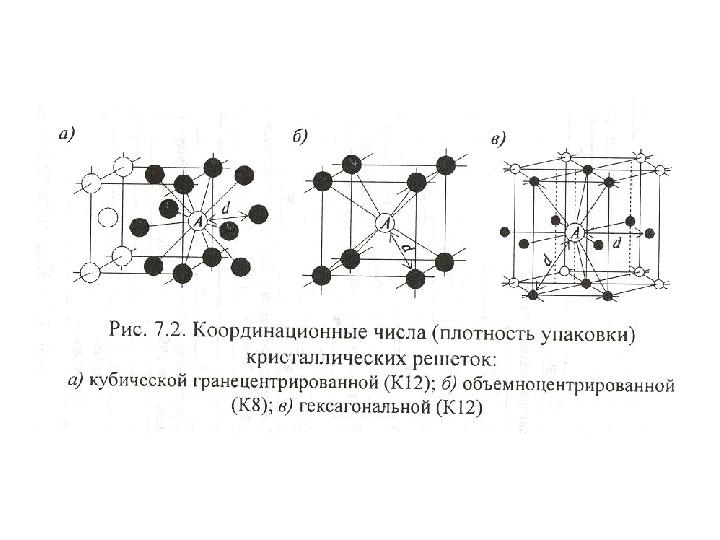
| Схема, показывающая число атомов, находящихся на равном и наименьшем расстоянии от данного атома ( А в различных кристаллических решетках. а — К12. 6 — К8. в — П2 ( С. С. Штейберг. |
На элементарную ячейку гранецентрированной кубической решетки приходятся четыре атома; из них один атом ( по такому же расчету, как и для объемноцентрированной решетки) вносят атомы, находящиеся в вершинах куба ( YsXS), и три атома вносят атомы, находящиеся на середине грани, так как каждый из таких атомов принадлежит двум решеткам.
На элементарную ячейку гранецентрированной кубической решетки приходятся четыре атома: из них один образуется за счет атомов в вершинах куба, а три — суммарная ( 1 / 2 — 6 3) доля атомов, находящихся в серединах граней, так как каждый из этих атомов принадлежит двум ячейкам.
Кубическая гранецентрированная решетка
Алюминий является трехвалентным растворителем и имеет кубическую гранецентрированную решетку. Первая зона Брил-люэна у алюминия может вместить только два электрона на атом, и поэтому она должна перекрываться поверхностью Ферми. Однако, как показал Харрисон , степень перекрытия может быть различной, если исходить из сферической формы поверхности Ферми, характерной для свободных электронов. Наличие такого перекрытия у чистого алюминия, очевидно, весьма незначительно отражается на периоде решетки при образовании сплавов.
Медь и золото, кристаллизующиеся в кубической гранецентрированной решетке, образуют между собой при повышенных температурах и закалке непрерывный ряд твердых растворов.
Медь и золото, кристаллизующиеся в кубической гранецентрированной решетке, образуют между собой при повышенных температурах и закалке непрерывный ряд твердых растворов. При отжиге происходит процесс упорядочения в распределении атомов золота и меди в кристаллической структуре, причем степень упорядочения будет наибольшей для атомных соотношений Си: Аи 3: 1 и Си: Аи 1: 1, отвечающих соединениям Cu3Au и CuAu. Поскольку каждый атом в вершине куба принадлежит одновременно восьми соседним ячейкам, на данную ячейку приходится / 8 атома ill.
Рассмотрим увеличение концентрации свободных электронов в кубической гранецентрированной решетке ограниченного а-твердого раствора при добавлении элемента с более высоким номером группы периодической системы по сравнению с растворителем.
| Гексагональная плотнейшая упаковка. Пример. Mg ( a 3 22. с 5 23 А. |
Стронций, подобно кальцию, кристаллизуется в кубической гранецентрированной решетке, а 6 05 А.
Стронций, подобно кальцию, кристаллизуется в кубической гранецентрированной решетке, а – 6 05 А.
Стронций, подобно кальцию, кристаллизуется в кубической гранецентрированной решетке, а – 6 05 А.
Ковкость уменьшается при переходе от кристаллов с кубической гранецентрированной решеткой к металлам с центрированной кубической и гексагональной решетками. Условия, определяющие образование или изменение кристаллической структуры, сильно влияют на ковкость металлов или сплавов. До определенной температуры ковкость растет за счет ослабления связи между кристалликами, а после достижения допустимой максимальной температуры ковкость уменьшается – металлы становятся хрупкими. Это связано с образованием окисных пленок между кристаллами.
Эта формула строго справедлива для кристаллов с кубической гранецентрированной решеткой, однако при применении ее для кристаллов с другими типами решеток погрешность незначительна. Следует учитывать, что такого типа расчеты применимы для монокристаллов. Обычно же имеют дело с поликристаллическими сростками.
В гальванических сплавах Си-Sn наряду с кубической гранецентрированной решеткой меди и тетрагональной решеткой олова обнаружены еще две промежуточные фазы. Рассмотрим более подробно несколько систем.
Структура фтористого кальция показана на рис. 10.4. Это кубическая гранецентрированная решетка.
СМ) 6 атомы железа расположены в узлах кубической гранецентрированной решетки. На рис. 22.5 атомы Fe ( II) представлены заштрихованными кружками, а атомы Fe ( III) – светлыми. На рис. а все атомы железа находятся в трехвалентном состоянии; на рис. б половина атомов – это Fe ( II), а другая половина – Fe ( III); атомы щелочных металлов обеспечивают электронейтралыюсть соединения. Они расположены в центрах чередующихся малых кубов; предполагается, что в гидратированпых соединениях молекулы воды также могут располагаться в пустотах основной сетки. Литий и цезий, представляющие собой соответственно очень малый и очень большой ионы, не дают соединений, имеющих такую структуру. На рис. в все атомы железа находятся в двухвалентном состоянии, и внутри каждого малого куба находится атом щелочного металла. Группы CN располагаются между атомами металла вдоль сплошных линий на рис. 22.5, так что каждый атом переходного металла находится в центре октаэдра из 6 атомов С или 6 атомов N. Таким образом, в целом комплекс состава M / M ( CN) 6 образует простую 6-связанную трехмерную сетку.
| Первая зона ник называется первой зоной Бриллюэна Бриллюэна, симметрич -, х.. |
На рис. 2.6 показана первая зона Бриллюэна для кубической гранецентрированной решетки.


![Кубическая кристаллическая система содержание а также решетки браве [ править ]](https://domdetaley.ru/wp-content/uploads/c/b/7/cb714c6b5cb9ebf10506bfda231d2dbb.jpeg)




![Кубическая кристаллическая система содержание а также решетки браве [ править ]](https://domdetaley.ru/wp-content/uploads/1/f/e/1fedc79d182924bfc9ea1e9b5010c7bc.jpeg)