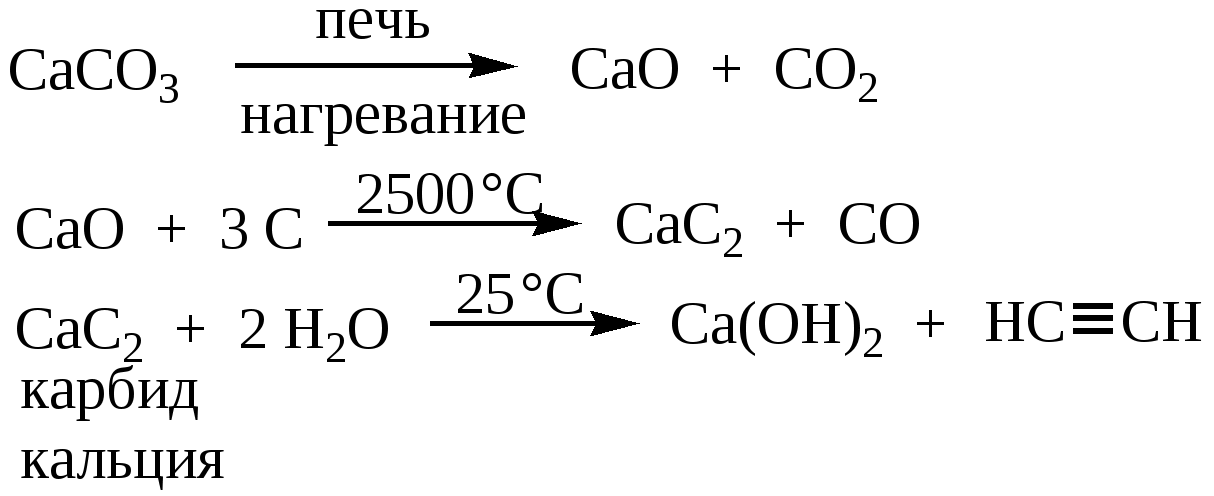Приложения [ править ]
Производство ацетилена править
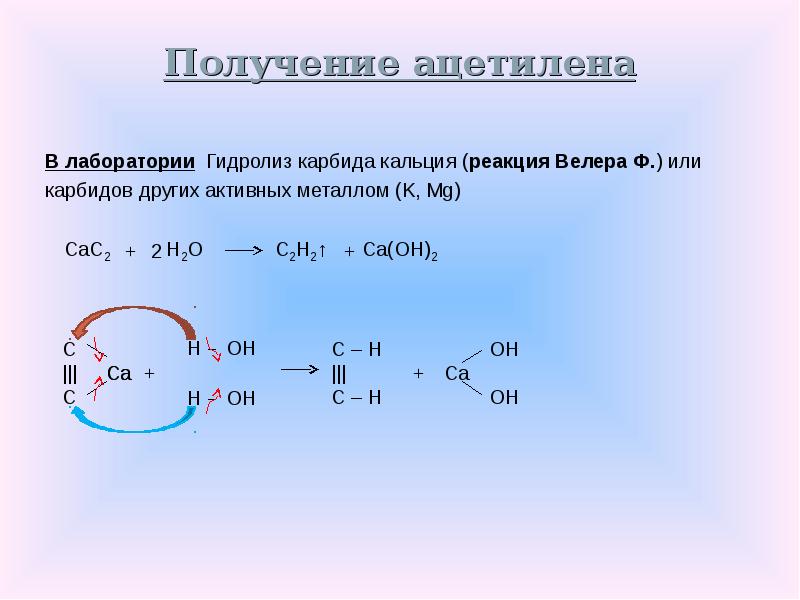
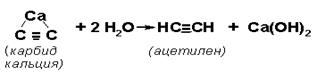
Реакция карбида кальция с водой, производя ацетилен и гидроксидом кальция , была обнаружена Фридрихом Вёлером в 1862 году.
- СаС 2 ( с ) + 2Н 2 O ( водно ) → С 2 Н 2 ( г ) + Са (ОН) 2 (водно)
Эта реакция легла в основу промышленного производства ацетилена и является основным промышленным применением карбида кальция.
Сегодня ацетилен в основном производится путем частичного сжигания метана или появляется как побочный продукт в потоке этилена при крекинге углеводородов. Таким образом ежегодно производится около 400 000 тонн (см. « Получение ацетилена» ).
В Китае ацетилен, полученный из карбида кальция, остается сырьем для химической промышленности , в частности для производства поливинилхлорида . Ацетилен местного производства более экономичен, чем использование импортного масла. Производство карбида кальция в Китае увеличивается. В 2005 году добыча составила 8,94 миллиона тонн при мощности производства 17 миллионов тонн.
В США, Европе и Японии потребление карбида кальция в целом снижается. Уровень производства в США в 1990-е годы составлял 236 000 тонн в год.
Производство цианамида кальция править
Карбид кальция реагирует с азотом при высокой температуре с образованием цианамида кальция :
- CaC 2 + N 2 → CaCN 2 + C
Цианамид кальция, широко известный как нитролим , используется в качестве удобрения. Гидролизуется до цианамида H 2 NCN.
Производство стали править
Карбид кальция используется:
- при обессеривании чугуна ( чугун , чугун и сталь)
- в качестве топлива в сталеплавильном производстве для увеличения доли брака в жидком чугуне, в зависимости от экономических соображений.
- как мощный раскислитель на ковшовых очистных сооружениях.
Карбидные лампы править
Горит карбидная лампа
Карбид кальция используется в карбидных лампах . При попадании капель воды на карбид образуется газ ацетилен, который горит и дает свет. Хотя эти лампы давали более устойчивый и яркий свет, чем свечи, они были опасны в угольных шахтах, где горючий газ метан представлял серьезную опасность. Наличие горючих газов в угольных шахтах привело к появлению ламп безопасности шахтеров, таких как лампа Дэви , в которой проволочная сетка снижает риск воспламенения метана. Карбидные лампы по-прежнему широко использовались на сланцевых , медных и оловянных рудниках, где метан не представлял серьезной опасности. Большинство шахтерских ламп теперь заменено электрическими лампами .
Карбидные лампы все еще используются для добычи полезных ископаемых в некоторых менее богатых странах, например, на серебряных рудниках недалеко от Потоси , Боливия . Карбидные лампы все еще используются некоторыми спелеологами, исследующими пещеры и другие подземные области , хотя их все чаще заменяют светодиодными .
Карбидные лампы также широко использовались в качестве фар в ранних автомобилях, мотоциклах и велосипедах, но были полностью заменены электрическими лампами.
Другое использование править
Карбид кальция иногда используется в качестве источника газообразного ацетилена, который является созревающим агентом, подобным этилену . Однако в некоторых странах это незаконно, поскольку при производстве ацетилена из карбида кальция загрязнение часто приводит к образованию следов фосфина и арсина
Эти примеси можно удалить, пропустив ацетиленовый газ через подкисленный раствор сульфата меди , но в развивающихся странах этой мерой предосторожности часто пренебрегают
Карбид кальция используется в игрушечных пушках, таких как Big-Bang Cannon , а также в бамбуковых пушках . В Нидерландах карбид кальция используется в преддверии Нового года для стрельбы из бидонов .
Карбид кальция вместе с фосфидом кальция используется в плавающих самовоспламеняющихся морских сигнальных ракетах , таких как те, которые производятся Ассоциацией защиты морской флоры и фауны Холмса .
Карбид кальция используется для определения влажности почвы. Когда почва и карбид кальция смешиваются в закрытом цилиндре под давлением, содержащаяся в почве вода реагирует с карбидом кальция с выделением ацетилена, давление которого можно измерить для определения содержания влаги.
Карбид кальция продается в коммерческих целях как средство от кротов . При контакте с водой добываемый газ отгоняет кротов.
Получение карбида кальция
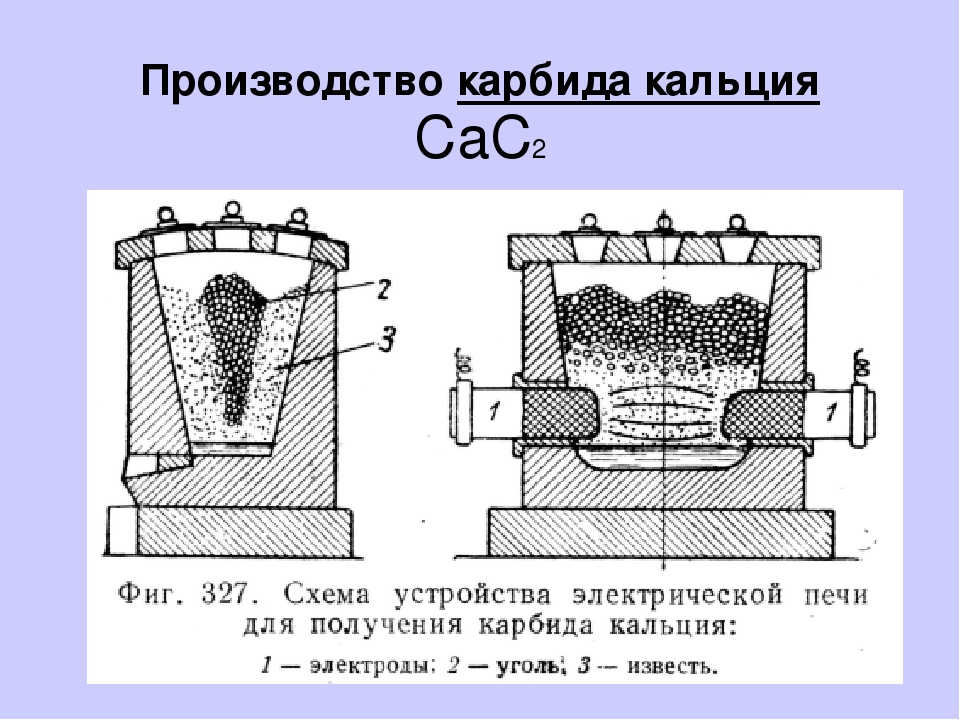
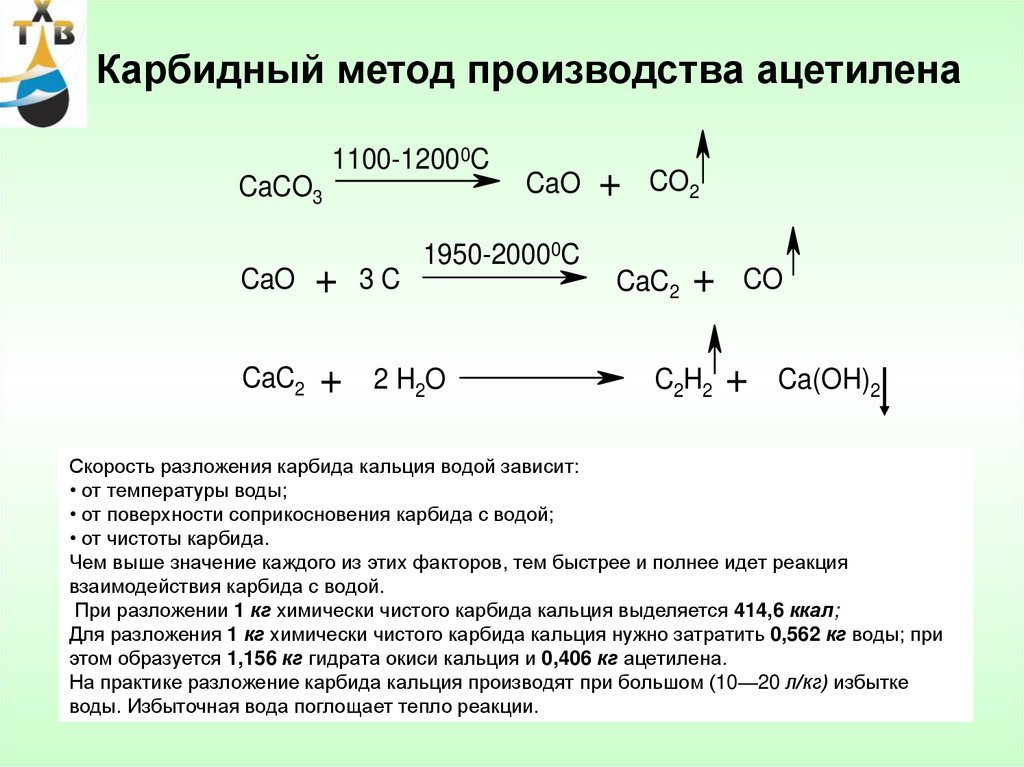
Технический карбид кальция получают в результате взаимодействия обожженной извести (СаО) с коксом (3С) или антрацитом в электрических печах при температуре 1900-2300°С. Шихту, состоящую из смеси кокса или антрацита и извести в определенной пропорции, загружают в электропечь, шихта расплавляется, при этом происходит эндотермическая химическая реакция (с поглощением тепла) по формуле:
СаО+3С = СаС2+СО -108 ккал/моль
Таким образом, для получения 1 т карбида кальция требуется:
- 4000 кг извести
- 600 кг кокса
- 1965 кВт·ч электроэнергии
Однако вследствие значительных потерь энергии в карбидных печах практически для получения 1 т технического карбида кальция расходуется от 2800 до 3700 кВт·ч в зависимости от мощности печи. Если мощность печи меньше 1000 кВт, то расход электроэнергии может достичь 4000 кВт·ч/т и более.
Расплавленный карбид кальция сливают из печи в специальные изложницы, в которых он остывает и затвердевает. После затвердевания его дробят в щековых дробилках и сортируют в решетчатых барабанах на куски различной величины от 2 до 80 мм.
Выход кусков различных размеров при дроблении приведен ниже:
| Грануляция, мм | 25-80 | 15-25 | 8-15 | 2-8 | до 2 |
|---|---|---|---|---|---|
| Выход, % | 66-80 | 8-10 | 6-14 | 4,5-6,5 | 1,5-3,0 |
Товарным карбидом кальция считается грануляцией от 2 до 100 мм. Карбидная пыль, получающаяся при дроблении, непригодна для нормальных ацетиленовых генераторов из-за слишком энергической реакции с водой, перегрева и опасности взрыва.
Зависимость удельного веса технического карбида кальция от содержания в нем СаС2, приведена в таблице ниже:
| Содержание СаС2 в техническом карбиде, % | 80 | 75 | 70 | 65 | 60 | 55 |
|---|---|---|---|---|---|---|
| Удельный вес технического карбида | 2,32 | 2,37 | 2,41 | 2.45 | 2,49 | 2,53 |
Технический карбид кальция, получаемый в электропечах, содержит ряд примесей, попадающих в него из исходных материалов, которыми пользуются при его производстве. Средний химический состав применяемого для сварки:
| Компонент | Содержание, % (по массе) |
|---|---|
| Карбид кальция (СаС2) | 72,5 |
| Известь (СаО) | 17,3 |
| Окись магния (MgO) | 0,4 |
| Окись железа (Fe2O3) и окись алюминия (Al2O3) | 2,5 |
| Окись кремния (SiO2) | 2,0 |
| Сера (S) | 0,3 |
| Углерод (С) | 1,0 |
| Другие примеси | 4,0 |
Как видно из приведенного состава, основной примесью является известь.
Примеси, содержащиеся в исходных материалах, применяемых для производства, ухудшают его качество. Особенно вредными примесями являются фосфор и сера, которые переходят в карбид кальция в виде фосфористых и сернистых соединений кальция, а при разложении карбида попадают в ацетилен в виде фосфористого водорода и сероводорода.
Химические свойства
Почти все карбиды взаимодействуют с водой. Какие-то — легко и без нагревания (например, карбид кальция), а какие-то (например, карбид кремния) — при нагревании водяного пара до 1800 градусов. Реакционная способность при этом зависит от характера связи в соединении, о котором мы поговорим позже. В реакции с водой образуются разные углеводороды. Происходит это потому, что водород, содержащийся в воде, соединяется с углеродом, находящимся в карбиде. Понять, какой углеводород получится (а может получиться как предельное, так и непредельное соединение), можно, исходя из валентности содержащегося в исходном веществе углерода. Например, если у нас есть карбид кальция, формула которого CaC2, мы видим, что он содержит ион C22-. Значит, к нему можно присоединить два иона водорода с зарядом +. Таким образом, получаем соединение C2H2 — ацетилен. Таким же образом из такого соединения, как карбид алюминия, формула которого Al4C3, получаем CH4. Почему не C3H12, спросите вы? Ведь ион имеет заряд 12-. Дело в том, что максимальное количество атомов водорода определяется формулой 2n+2, где n — количество атомов углерода. Значит, может существовать только соединение с формулой C3H8 (пропан), а тот ион с зарядом 12- распадается на три иона с зарядом 4-, которые и дают при соединении с протонами молекулы метана.
Интересными представляются реакции окисления карбидов. Они могут происходить как при воздействии сильных смесей окислителей, так и при обыкновенном горении в атмосфере кислорода. Если с кислородом всё понятно: получаются два окисда, то с другими окислителями интереснее. Всё зависит от природы металла, входящего в состав карбида, а также от природы окислителя. Например, карбид кремния, формула которого SiC, при взаимодействии со смесью азотной и плавиковой кислот образует гексафторкремниевую кислоту с выделением углекислого газа. А при проведении той же реакции, но с одной только азотной кислотой, получаем оксид кремния и углекислый газ. К окислителям также можно отнести галогены и халькогены. С ними взаимодействует любой карбид, формула реакции зависит только от его строения.
Карбиды металлов, формулы которых мы рассмотрели — далеко не единственные представители этого класса соединений
Сейчас мы подробнее рассмотрим каждое промышленно важное соединение этого класса и затем поговорим об их применении в нашей жизни

Лабораторный опыт получения ацетилена
Многим из школьных уроков химии знакома реакция взаимодействия карбида с водой. Обычно этот опыт позволяет продемонстрировать реакцию получения ацетилена, а также физические и химические его свойства. Процесс выделения газа при этом происходит достаточно бурно, поэтому трубка, отводящая ацетилен из колбы с действующими веществами, помещается в чашу с водой. Это обеспечивает менее активное и стремительное движение газа. Кроме того, в лабораторных условиях можно использовать и другой способ, чтобы сделать не слишком бурной реакцию разложения такого соединения, как карбид. Ацетилен при этом идет равномерно и спокойно. Для этого вместо воды необходимо взять насыщенный раствор поваренной соли
Также в лаборатории при проведении этой реакции следует осторожно добавлять воду в карбид, помещенный в объемную колбу, а не наоборот
Что такое «карбид», знает любой мальчишка. Если бросить кусочек карбида в лужу, то кроме дикого шипения получается еще дичайшая вонь. А как получается сам карбид?
Вообще карбидов существует множество, как и применений ему. Но нас пока интересует карбид кальция CaC 2 — то есть тот, который используют для получения ацетилена при соединении карбида с водой.
Слишком сложного в получении карбида кальция нет. Сейчас для этого в электропечах пережигают негашеную известь с коксом. При всей этой простоте — впервые карбид кальция был получен в лаборатории в 1836-м году, а промышленно его начали получать в 1892 году. Для попаданца — широчайшее поле для внедрения!
Все реакция — CaO + 3C = CaC 2 + CO Негашеная известь соединяется с углеродом. Негашеную известь получали с древних времен, пережигая известняк, ну и древесный уголь тоже дефицитом не был никогда. Полученный попутно угарный газ (СО) окисляется до углекислого газа прямо при выходе из печи, хотя сейчас часто печи делают закрытыми для сбора угарного газа. На 100 весовых частей негашеной извести нужно 70-80 весовых частей углерода. При производстве лучше иметь избыток угля, чем извести — такой карбид отдает больше ацетилена. Готовый карбид кальция технического качества почти на 80% состоит из самого карбида кальция, 17% — известь, остальное примеси. Карбид выходит в виде расплава, который после затвердевания измельчают.
Но, несмотря на простоту реакции получения, есть некоторые неприятные нюансы. Главное — процесс этот эндотермический, он поглощает дикое количество тепла в процессе производства — 3000 кВт на тонну продукта. Именно из-за этого его делают электродуговым способом. При этом сам процесс идет в жидкой фазе — то есть расплавленная известь постепенно реагирует с кусками углерода. При этом нужна температура примерно 2000°С, что совсем немало. И что совсем неприятно — при перегреве до 2200-2400°С карбид кальция распадается на составляющие.
Поэтому, если нам не доступно электричество в больших объемах, у нас есть два выхода.
Первый — это плавить в тигле. Проблема в том, что тигель должен выдержать эти самые 2000°С, а в древние времена ни графитовый, ни вольфрамовый тигель нам будут недоступны.
Второй — построить небольшую доменную печь. Требуемое тепло даст избыточное количество угля. Уголь и известь насыпаются туда слоями и печь поддувается большим количеством воздуха. Такие печи пытались строить и главная проблема — поддержка точных условий реакции, что регулируется силой поддува. С одной стороны — такую печь можно построить только когда уже работают доменные печи для железа. А с другой стороны — а нам точно нужен карбид, если нет даже железа?
Трудность вызовет хранение карбида. Он должен быть абсолютно изолирован от воды — много лучше, чем порох. Потому что если порох намокнет, то он не взорвется, а если намокнет карбид — то взрыв обеспечено. И что хуже всего — при хранении не должна использоваться медь, серебро или золото.
Проблем с производством карбида будет немало. Но при каком производстве их будет мало? Зато все проблемы — решаемые чуть ли не с технологиями Древнего Египта. А пользы от карбида будет много…
И последнее — ацетилен, который получается после контакта карбида с водой — ничем не пахнет, человек просто не имеет обонятельных рецепторов для него. Та вонь, по которой мы безошибочно определяем карбид — это примеси, которых в техническом карбиде несколько процентов.
Применение карбида кальция
Как ранее было отмечено, карбид кальция встречается в самых различных областях промышленности, зачастую поставляют для проведения промышленного синтеза. Свойства карбида кальция и реакция, протекающая при его соединении с различными веществами, определяют использование вещества в нижеприведенных случаях:
- Многие синтетически компоненты, входящих в состав современных материалов, производят на основе рассматриваемого компонента.
- Применяется для получения цианамида кальция. Подобный компонент используется для получения различных химических удобрений. Именно поэтому сырье применяется для регулирования скорости роста растений.
- Цианамид кальция также получают при соединении вещества с азотом.
- В некоторых случаях проводится восстановление металлов щелочной группы.
- Можно использовать рассматриваемое соединение в процессе газовой сварки.
При рассмотрении карбида кальция и области применения стоит учитывать, что подобное вещество чаще всего применяют для получения ацетилена. Подобный синтез карбида кальция разработал немецкий ученый. Среди особенностей подобного способа применения отметим следующие моменты:
- Ацетилен из карбида получают при оказании воздействия водой на используемое сырье.
- В результате прохождения химической реакции образуется требующийся газ, гашеная известь выпадает в осадок.
- Стоит учитывать, что при смешивании компонентов выделяется большое количество тепла. Поэтому работа должна проводится с учетом техники безопасности.
- В зависимости от вида применяемой технологии переработки сырья с 1 килограмма выходит около 290 литров газа.
- Скорость протекания процедуры зависит от чистоты применяемого сырья, температуры и количества воды.

Получение ацетилена из карбида кальция
Как показывает практика, при использовании чистого карбида на протекание химической реакции отводится около 20 литров волы на 1 килограмм сырья. Подобное количество воды требуется для того чтобы снизить температуру реакции, за счет чего обеспечиваются оптимальные условия для работы.
Методы получения карбидов
Карбиды могут быть получены взаимодействием углерода и его соединений с металлами или их соединениями. Известны следующие способы получения карбидов: 1) получение карбидов в литом виде;
2) науглероживание порошков металлов (или окислов) твердым углеродом;
3) науглероживание порошков металлов (или окислов) газами, содержащими углерод (часто в присутствии твердого углерода);
4) осаждение из газовой фазы (метод наращивания);
5) химическое выделение карбидной фазы или углеродистых ферросплавов или расплавов (метод растворения);
6) электролиз расплавов соответствующих солей.
Промышленное применение имеют первые три способа.
Получение литых карбидов основано на сплавлении металлов с углеродом и возможно только в электрической или высокочастотной печи, так как температуры образования и плавления карбидов тугоплавких металлов лежат в пределах 2500—4000° С. Это вызывает определенные технические трудности, поэтому способ получения литых карбидов имеет ограниченное применение.
Получение карбидов науглероживанием порошков металлов или окислов металлов твердым углеродом имеет наибольшее распространение и используется для промышленного приготовления карбидов вольфрама, титана, молибдена, тантала, ванадия и других карбидов, применяемых в производстве твердых сплавов.
В качестве исходного сырья при этом способе используют порошки чистых металлов или их окислов. Углерод вводят в смесь в виде тонкого порошка сахарного угля или сажи. Смесь металла (или окисла) с углеродом тщательно перемешивают в шаровых мельницах всухую или мокрым способом. При смешивании металла с твердым углеродом дают от 5 до 10% избытка углерода (по сравнению с теоретическим содержанием его), так как в металлических порошках имеется остаточный кислород, а также для компенсации частичного выгорания углерода в печи.
При использовании смесей окислов металла с углеродом учитывают науглероживающее действие образующейся окиси углерода и применяемого защитного газа. Обычно для реакции достаточно 80—90%-ного количества углерода, которое соответствует уравнению
Науглероживание (карбидизацию) проводят в одну или несколько стадий в электрических или реже в газовых печах. Кроме муфельных печей непрерывного действия, применяют угольные трубчатые печи сопротивления, методические печи с молибденовыми нагревателями и вертикальные трехфазные криптоловые печи, а также высокочастотные печи периодического действия с графитовыми тиглями.
В качестве защитного газа используют водород, окись углерода, метан и смеси этих газов. При получении карбидов волфрама и молибдена в качестве защитного газа можно использовать генераторный газ или диссоциированный аммиак.
Реакция науглероживания при образовании монокарбидов протекает по следующим уравнениям:
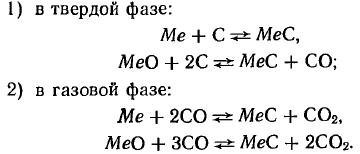
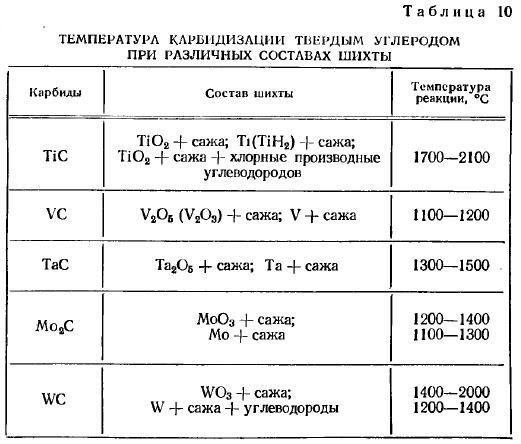
Карбиды молибдена, вольфрама и тантала лучше всего получать науглероживанием металлических порошков сажистым углеродом при температуре 1200—1600°С.
Вольфрам образует два стойких при комнатной температуре карбида: W2C и WC. При науглероживании в твердом состоянии образуется преимущественно монокарбид вольфрама WC, при науглероживании в расплаве образуется W2C. Металлокерамические твердые сплавы содержат исключительно монокарбид вольфрама.
Карбид титана готовят из смеси возможно более чистой двуокиси титана с газовой сажей при температуре 1700—2100° С.
Получение карбидов науглероживанием металловили окислов углеродсодержащими газами. Выше было показано, что при карбидизации в твердом состоянии науглероживание частично происходит и через газовую фазу. В связи с этим возможно получение карбидов науглероживанием исключительно через газовую фазу. Для этого обычно используют металл и углеводород, в результате реакции получают карбид металла и водород. Газовая карбидизация металлов происходит при более высокой температуре.
Науглероживание окислов углеродсодержащими газами проводится редко.
Техника безопасности при работе с карбидом кальция.
Как уже Вам известно, карбид кальций — это взрывоопасное вещество и для обеспечения безопасной работы с ним необходимо выполнять несколько обязательных правил при использовании карбида для сварки. Главные положения, которые необходимо выполнять при сварочных работах на основе карбида кальция:
Учитывайте, что карбид кальция активно взаимодействует с воздухом и водой, выделяя легковоспламеняющийся ацетиленовый газ
Место хранения карбида для сварки должно быть сухим и герметичным.
Карбид кальция также взрывоопасен, поэтому искры и открытый огонь рядом с веществом строго воспрещены.
Пыль карбида (куски менее 2 мм) вызывают раздражения, попадая на кожу, глаза и слизистую оболочку рта, и носа.
Регулярные сварочные работы с применением карбида кальция должны проводиться в специально оборудованном для сварки помещении, в котором нет горючих веществ, и присутствуют только несгораемые материалы
Жизненно важно, чтобы все оборудование, связанное с хранением и производством ацетилена было изолировано в отдельных отсеках сварочной мастерской, а само помещение для генераторов должно легко проветриваться и в случае чего деактивироваться.
Установка генераторов ацетилена строго запрещена в подвальных комнатах.
После завершения сварочных работ с применением карбида кальция как «топлива», в генераторах все оставшееся вещество дорабатывается, и полученные шлаки в виде известкового ила удаляем из генератора в специальную яму или бункер.
Напомним, что карбид и ацетилен — взрывоопасные вещества. Поэтому курение, открытый огонь на расстоянии до 10 метров от места хранения отработанного карбида строго воспрещено.
При перевозке и хранении ацетиленовых баллонов, на конструкцию клапанов должны быть навинчены предохранительные колпаки
Толчки и удары при транспортировке нескольких баллонов смертельно опасны. Хранение и перевозка ацетиленовых баллонов с другими веществами не допустима.
И напоследок отметим, что карбид кальция является высокоинтенсивным веществом для получения ацетиленового газа, что сводит к минимуму его расход. Кроме того, один килограмм ацетилена, полученного из карбида кальция, выделяет тепла около 8 тысяч кДж.
Карбиды — это соединения металлов и неметаллов с углеродом. Обычно в таких соединениях углерод имеет большую электроотрицательность, чем второй элемент, что позволяет исключить из группы оксиды, галогены и другие углеродные соединения.
Это твердые тугоплавкие вещества, нелетучие и нерастворимые. В основном они обладают разнообразными свойствами: некоторые, например, карбид золота, может взорваться при попытке пересыпать его, а некоторые из соединений, например, бора, циркония, титана, кремния и вольфрама, по твердости превосходят алмаз и не поддаются действию кислот и растворителей.
Это интересно: Что такое курвиметр — характеристики и назначение прибора
Карбид: что это такое. Свойства, производство, применение
instrument.guru > Металлообработка > Карбид: что это такое. Свойства, производство, применение
Карбиды металлов — это соединения, которые не являются природными, получают их только искусственным путем.
Первое упоминание о создании этого вещества относится к началу 19 века, его синтезировал англичанин Деви в своей лаборатории. Позже были созданы и другие соединения.
В детстве многие любили взрывать это вещество, но далеко не все понимают, что же представляет из себя это соединение.
- Состав и виды карбидов
- Свойства
- Производство карбида
- Применение в промышленности
- Хранение и транспортировка
- Стоимость
Хранение и транспортировка
Поскольку карбид при вступлении в реакцию с влагой приводит к выделению большого количества тепла и взрывоопасного газа ацетилена, хранят данное вещество в герметичных баках или барабанах
Работа с такими баками требует особой осторожности
Газ ацетилен легче воздуха и способен самовоспламеняться, при этом обладает наркотическим действием.
При вскрытии барабанов с карбидом используют специальный инструмент, исключающий возникновение искр, а при попадании вещества на кожу требуется немедленно промыть водой пораженный участок и смазать жирным кремом.
Помещения хранения должны хорошо проветриваться, а содержание других веществ по соседству — запрещено. Это может привести к опасным реакциям. Неправильное хранение может как взорвать карбид, так и привести его в негодное состояние.
Срок хранения доходит всего до полугода.
Перевозка осуществляется только крытым транспортом. Воздушная доставка запрещена.
Стоимость
А вот, карбид вольфрама обойдется в 1400 рублей за кило. Причем, может быть установлен минимальный вес покупки, например, от 10 кг. Карбид бора будет стоить еще дороже — от 2000 рублей, причем фасовка начинается от 35 килограмм.
Стоимость же соединений с гафнием или молибденом оговаривается с поставщиком отдельно.