Чугун.

Чугун – сплав железа с большим количеством углерода (не менее 2,14%). Углерод придаёт твёрдость, но снижает пластичность. В зависимости от формы графита и количества цементита, различают белые, серые, ковкие и высокопрочные сорта чугуна. Как правило, из чугуна производят изделия методом литья. Трудность в покрытии чугуна заключается в наличии литейной корки, при повреждении которой качественное покрытие получить не удается. Кроме этого, за счет высокой науглероженности чугуна, при травлении на его поверхности выступает много карбидов железа в виде порошка, усложняющих получение прочно сцепленного покрытия. Оцинковка чугуна из щелочных растворов затруднена преимущественным выделением водорода, а не цинка.
Химическое осаждение металлов.
Процесс химического осаждения металлов (ХОМ) представляет собой окислительно-восстановительную реакцию. продуктом которой является металл:
Men+ + Red → Me + Ox
Термодинамическая вероятность такой реакции определяется разностью потенциалов восстановителя и окислителя, с одной стороны, и устойчивостью воды – с другой стороны, т. к. многие металлы разлагают воду и не могут быть выделены из водных растворов.
В качестве восстановителя могут быть использованы гипофосфит-ион, формальдегид, борогидрид, гидразин, ионы металлов переменной валентности (Sn2+, Ti3+ и др.). Соответствующие уравнения приведены в таблице 5. Термодинамически протекание какой-либо реакции возможно в той области рН и потенциалов, где устойчивы состояния продуктов этой реакции. Применительно к ХОМ это означает, что реакция протекает в области, где металл находится в восстановленной форме, а восстановитель – в окисленной. Для обеспечения протекания окислительно-восстановительного процесса ХОМ необходимо увеличение восстановительной способности восстановителя (например, формальдегида), что достигается смещением рН в сторону больших значений.Таблица 5 – Уравнения, описывающие системы “восстановитель-вода” в щелочных растворах.
№ | Равновесие | Уравнение, описывающее равновесие |
1 | H2PO2-+H2O=H2PO3-+2H++2e | E=-0,504-0,06pH |
2 | HCHO+3OH-=HCOO-+2H2O+2e | E=-0,19-0,09pH |
3 | BH4-+OH-=BO2-+6H2O+8e | E=-0,40-0,06pH |
4 | N2H4+4OH-=N2+4H2O+4e | E=-0,31-0,06pH |
5 | HSnO2-+H2O+3OH-=Sn(OH)62-+6e | E=-0,33-0,09pH |
6 | Ti3+=Ti4++e | E=-0,04 |
Материалы для технологии
Необходимое оборудование если проводится гальванопластика дома
- Металлический объект, подлежащий покрытию (должен быть стальным).
- Блок питания (3v-6v).
- Сульфат цинка / гидроксид цинка / хлорид цинка.
- Вода.
- Стакан (вместо стеклянного или пластикового объекта).
- Цинк (может быть найден внутри батареек Zn-C).
- Песочная бумага (120).
- Гальваническая ванна, сделанная своими руками или подобная емкость.
- Тканевая бумага.
- Провода.
- Чистое рабочее место достаточное для гальваники.
- Необходим источник постоянного тока с регулировкой напряжения, домашняя розетка не подходит.

Гальваническая установка
Что нужно для приготовления электролита в домашних условиях? Для различных изделий требуются различные составы раствора. Для раствора используют воду с кислотами и другими важными включениями солей, металлов. Гальваника своими руками позволить обработать многие детали и инструменты для декора или повышения износостойкости. Температура электролита в различных операциях играет разную роль. Например, при хромировании чем температура выше, тем ярче выражается покрытие.
Подготовка материала
Перед проведением работ необходимо подготовить изделия. Для заготовок, проводящих ток, процесс состоит из нескольких этапов:
- очистки от ржавчины, налета, грязи;
- обезжиривания детали в заранее подготовленном составе;
- сушки поверхностей.
Если говорить о диэлектрических заготовках, подготовка выглядит иначе. Пошаговая инструкция:
- Поверхности зачищаются от грязи, пыли, обезжириваются, высушиваются.
- Если изделие содержит каучук, поверхность необходимо протереть спиртом, высушить. После сушки кистью нанести слой коллоидного графита. Втирать смесь 10 минут. Удалить остатки графита сжатым воздухом.
- Чтобы начать работать с деталями со сложным рельефом, необходимо нанести металлическую пленку. Изначально изделие обезжиривается Венской известью, смешанной с синтетическим моющим средством. Пропорции 1 к 1. После обезжиривания необходимо погрузить деталь в раствор сенсибилизации (длительность выдержки — 10 минут).
После обработки химикатами изделие промывают под проточной холодной водой.
Металлическая статуэтка (Фото: Instagram / _galvanoplastika_)
Простые и комплексные электролиты в гальванотехнике.
Традиционно в гальванике применяются простые и комплексные электролиты. Отличие состоит в том, в какой форме находятся ионы осаждаемого металла. Простые электролиты содержат сульфаты, нитраты, хлориды и т.п. и осаждаемый металл в них находится в форме простой соли. Соответственно, электролиты будут называться сульфатные, нитратные, хлоридные и т.п. Если используется смесь солей, то название будет двойным, тройным и т.д., например, сульфатно-нитратные, сульфатно-хлоридные.
В комплексном электролите ион осаждаемого металла связан в комплекс. Характеристикой комплексного электролита является константа нестойкости комплекса – чем она меньше, тем прочнее комплекс. В электролитах, комплекс которых имеет минимальную константу нестойкости, металл осаждается с наибольшим перенапряжением и, соответственно, покрытие получается наиболее мелкокристаллическим, а рассеивающая способность электролита и равномерность покрытия по толщине – максимальная. На практике наиболее прочные комплексы получаются обычно с цианид-ионами.
Для примера рассмотрим таблицу 4, в которой приведены значения констант нестойкости комплексов серебра и рисунок 14, где приведены некоторые поляризационные кривые осаждения серебра из различных комплексов. По рисунку 14 можно заметить, что чем меньше константа нестойкости комплекса, тем больше поляризация, что визуально выражается в более пологой кинетической кривой.
На практике часто применяются следующие виды комплексных электролитов: цианидные, аммиачные, пирофосфатные, роданистые, гидроксидные, борфтористоводородные. Другие комплексы применяют реже.Таблица 4 – Значения констант нестойкости некоторых комплексов серебра.
Вид комплекса серебра | Константа нестойкости |
Аммиачные | 10-3-10-4 |
Бромидные | 10-5-10-10 |
Гидроксидные | 10-3 |
Йодидные | 10-11-10-15 |
Роданидные | 10-8-10-11 |
Селеноцианатные | 10-12-10-13 |
Сульфитные | 10-3-10-6 |
Хлоридные | 10-3-10-7 |
Цианидные | 10-22 |
2,2′ дипиридильные | 10-7 |
Тиосульфатные | 10-14 |
Этилендиаминовые | 10-5-10-8 |
Тиомочевинные | 10-14 |
Трилонатные (ЭДТА) | 10-8 |
Пирофосфатные | 10-7 |
Сульфосалицилатный | Нет данных |
Метансульфонатные | Нет данных |
Димитилгидантоиновый | 10-10 |
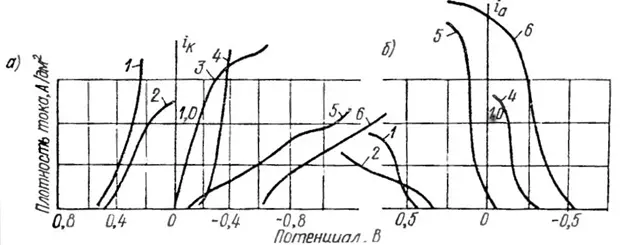
Рисунок 14 – Катодные (а) и анодные (б) поляризационные кривые серебра при одинаковом содержании его в электролите: 1- пирофосфатный, 2 – роданистый, 3 – йодистый, 4 – синеродистороданистый, 5 – цианистый, 6 аммиакатносульфосалицилатный.
Техника безопасности
Чтобы обезопасить свой организм, нужно соблюдать ряд правил:
- Работать используя респиратор, защитные очки, перчатки, спецодежду.
- Помещение должно иметь хорошую вентиляцию, чтобы вредный пары выходили наружу.
- Из рабочей зоны следует убрать взрывоопасные вещества, разные виды топлива.
- При работе нельзя употреблять пищу или воду. Делать это можно только в отдельном помещении.
Соблюдая правила, можно снизить риск отравления, получения травмы.
Гальванопластика применяется для создания точных копий разных изделий. Технология представляет собой восстановление заготовки оседающими металлическими частицами на ее поверхности. Поскольку работа связана с применением едких химических веществ, нужно соблюдать технику безопасности.
Гальваника на производстве
Особенность этого вида металлообработки — высокая техническая сложность. Требуется специальное оборудование, качественные реактивы, точное соблюдение технологий. Лишь опытные специалисты по гальванотехнике работают безошибочно.
Также гальваника
относится к токсичному производству, многие реагенты представляют опасность для людей. Необходимо обеспечить должную защиту персонала, исключить контакт посторонних лиц с гальваническими ваннами.
Гальваника
подразделяется на никелирование, хромирование, меднение, цинкование, свинцевание, лужение (покрытие оловом). Практикуется анодирование (оксидирование) алюминиевых заготовок для придания им глубокого красивого блеска.
Только немногие предприятия в Москве в состоянии обеспечить правильное и своевременное выполнение заказов. Намного проще и выгоднее заказать проведение работ профессионалам, чем пытаться создать собственный гальванический цех.
Гальваника с раствором металлического ионного электролита в домашних условиях
Для гальваники в домашних условиях с помощью этого метода вам понадобится кусок меди, металл, который должен быть покрыт, уксус, перекись водорода, зажимы, батарея 6-вольтового фонаря, пластиковый контейнер.
Используйте контейнер, достаточно большой, чтобы затопить материал, который вы пытаетесь залить.
Смешайте и нагрейте равные части уксуса и перекиси водорода. Чтобы сделать четыре чашки раствора, добавьте две чашки уксуса в две чашки перекиси водорода
Сочетание уксуса и перекиси водорода делает перуксусную кислоту, с которой следует обращаться с осторожностью.
Следует растворить медную болванку в составе. Жидкость станет синей, что указывает на то, что в растворе содержатся ионы меди, которые можно использовать для гальванопокрытия материала.
Замачивайте медь до тех пор, пока раствор не станет голубым
Лучше, чтобы раствор имел слабую концентрацию, раствор не должен быть слишком темным.
Прикрепите зажимы к аккумулятору. Батарея обеспечивает ток, необходимый для транспортировки металлов от донора к получателю. Подсоедините один зажим-аллигатор к положительной клемме аккумулятора и другой зажим к отрицательной клемме.
Очистите металл в домашних условиях, подлежащий гальваники. Перед запуском метода гальванизации вы должны убедиться, что металл чист, поэтому новые атомы могут образовывать твердую связь с металлом-реципиентом.
Подключите положительный зажим к медной части.
Подключите отрицательный аллигатор к металлическому покрытию. Постарайтесь прикрепить аллигатор в неприметном месте. Если вы прикрепляете металл к положительному полюсу, гальваника не будет работать.
Погрузите элементы в медную жидкость. Как только оба металла будут подключены, погрузите их в голубой медный раствор, приготовленный ранее. Поскольку они подключены к аккумулятору, ток протекает через цепь. Процедура длится до удовлетворительного уровня покрытия.

Все необходимое для изготовления электролита
Особенности процесса
Гальваника, в том числе в домашних условиях, очень похожа на электролиз (где используется электричество для разделения химического раствора), что является обратной процедурой, при которой батареи производят электрические токи.
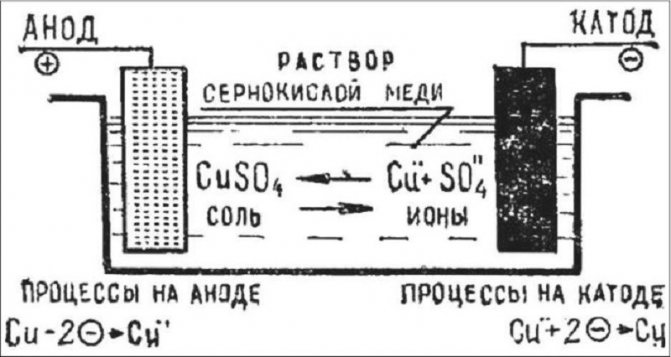
Схема электролиза
Необходимо использовать для гальваники в домашних условиях правильные электроды и электролитный раствор, предопределив химическую реакцию или реакции, которые будут протекать, когда электрический ток начнет действие. Атомы, которые присоединяются к изделию, поступают из электролита. Поэтому, если происходит процесс гальваники для покрытия из меди вам нужен медный электролит, а для золотого покрытия вам необходим электролит на основе золота.
Мастеру во время гальваники необходимо убедиться, что изделие, которое будет использоваться, полностью чистое. В противном случае, когда на него будут поступать атомы из электролита, они не образуют хорошей связи, и элементы могут просто выпасть в осадок. Как правило, очистка проводится путем погружения электрода в сильный кислотный или щелочной раствор, или путем (короткого) подключения цепи гальванопокрытия в обратном направлении. Если электрод действительно чист, атомы от металлизации соединяются в очень сильную кристаллическую структуру.

Обработанные золочением предметы
Гальваника выполняемая в домашних условиях включает пропускание электрического тока через электролит. Это делается путем погружения в электролит двух клемм, называемых электродами, и подключения их к цепи с батареей или другим источником питания. Электроды и электролит изготавливаются из тщательно отобранных элементов или соединений. Когда электричество протекает через контур, электролит расщепляется, и некоторые из атомов материала, которые он содержит, осаждаются в тонком слое поверх одного из электродов. Таким образом, реализуется гальванопластика дома Все виды металлов могут быть покрыты таким образом, включая золото, серебро, олово, цинк, меди, кадмия, хрома, никеля, платины и свинца.
Чтобы получить ровное гальваническое покрытие, мастер должен сначала очистить поверхность вашего металлического предмета и подготовить необходимое оборудование. Грязь и масла на поверхности могут помешать донорскому элементу покрывать поверхность. Начните с обезжиривания, моющим средством (мыло для посуды), а затем протрите металл абразивным кислотным очистителем, чтобы поверхность была очень чистой.
Общие сведения о гальванопластике.
Гальванопластика – техника получения точных металлических копий с форм путем электроосаждения. Точнее это гальванический способ формования изделий, в процессе которого металл, выделяющийся при электролизе, достигает толщин 0,25-2 мм и воспроизводит форму поверхности, на которой осаждается. В результате покрытие становится самим изделием.
В настоящее время в гальванопластике применяют: Cu, Ni, Ni-Co, Ni-Fe, Ni-Si, Ni-W, Fe, Pb, Cr, Au, Ag. Из расплавленных солей создают гальванопластические копии с применением тугоплавких металлов: Re, W, Mo.
Частным случаем гальванопластики является электролитическое формование. Разница между этими процессами в том, что в гальванопластике форма отделяется от копии или разрушается, а в электроформинге – остается внутри.
Важными аспектами в процессе гальванопластического формирования изделий играет подготовка поверхности используемой формы, создание на ней токопроводящего и/или разделительного слоя.
Гальванопластику создал русский ученый Борис Семенович Якоби в 1836 г. При опытах с элементами Даниеля, Якоби “…увидел несколько почти микроскопических царапин напильника, точно соответствующих друг другу: вогнутые на поверхности цилиндра и рельефные – на поверхности отдельного листочка. Гальванопластика явилась следствием этого тщательного исследования”.
Увидев такое интересное явление, Якоби сразу же начал поиск его технического применения. 5 декабря 1838г. на заседании Академии наук был прочитан доклад Якоби об изобретении техники гальванопластики и продемонстрированы образцы гальванопластических копий гравированных печатных форм.
Преимущества гальванопластики как метода формования:
- высокая точность воспроизведения микро- и макрогеометрического сложного рельефа поверхности, на которую производится электроосаждение металла;
- низкая стоимость оснастки и оборудования, что позволяет часто менять конструкцию деталей;
- многократное использование моделей для наращивания;
- тождественность деталей, снимаемых с одной модели;
- в условиях многосерийного производства возможность одновременно изготовлять большое количество деталей, которое определяется размерами ванн и мощностью источников тока;
- получение комбинированных деталей, как из различных металлов, так и неметаллов;
- малые затраты труда по сравнению с такими методами формообразования, как литье, штамповка, механическая обработка.
Недостатки гальванопластики:
- Ограничения в перечне используемых металлов и сплавов;
- Относительно невысокая скорость осаждения;
- Неравномерность распределения электролитических осадков по рельефной поверхности, что влечёт за собой увеличения стадий механической обработки.
Область применения гальванопластики очень обширна: бесшовные трубы, волноводы, сильфоны, гильзы с кумулятивным зарядом, художественные изделия, компоненты для исследований в области термоядерного синтеза и ядерной энергии, датчики шероховатости поверхности, золотые коронки и мосты для стоматологии, калибровочные шкалы для электронной микроскопии, корпуса для слуховых аппаратов, микроустройства для электронного, микромеханического применения и многое другое.
Особенности независимой процедуры
Чтобы правильно и надёжно осуществлять процесс нанесения хрома своими руками, следует принимать во внимание все характерные черты химических и физиологических преображений, которые совершаются. Большая часть химических элементов, участвующих в хромировании, представлена особенно опасными элементами, следовательно, прежде чем приступать к проведению эксперименты с хромированными покрытиями, тщательно изучить необходимо теоретическую сторону процесса

Хром придаёт плоскости замечательный наружный вид, благодаря которому продукция приобретает весьма изящный вид. Гальваника открывает большие возможности для усовершенствования декоративных, физиологических и химических качеств материалов. Хром чрезвычайно устойчив к воздействию агрессивных сред, он не темнеет под воздействием окружающей среды, благодаря этому он отыскал обширное применение при конструировании частей кузовов автомобилей и частей элементов, работающих в сложных условиях. Толщина блестящего напыления весьма мала: от 0,075 до 0,25 миллиметров.
Ещё одна проблема, которая может остановить на пути к осуществлению задачи — получение реактивов. Главным компонентом является соединение хрома (CrO3), иное наименование — ангидрид хрома. Неприятной чертой его применения является то, что оксид хрома является самым мощным ядом, смертельная доза которого — 6 г. Это соединение имеет небольшой оборот, который строго контролируется государством.
Остатки, возникающие в результате завершения хромирования, должны быть утилизированы в соответствии со специальным порядком, а не поступать в канализацию или в почву. Элемент является сильным канцерогеном: если он появляется на коже, будет очень сильное раздражение, в том числе экзема и дерматит, может сформироваться опухоль.
Преимущества и история развития
Эта технология была изобретена в 1838-м году ученым по имени Борис Якоби. Именно он начал активное внедрение гальваники в самые разные процессы производственного плана. В скором времени гальваническую обработку успешно освоили и монетные дворы, и художники-ремесленники, и промышленные предприятия.
Однако название эта методика получила в честь ученого из Италии Луиджи Гальвани. Он начал изучение электрохимической технологии обработки почти одновременно с Борисом Якоби.
К основным достоинствам гальваники относятся следующие:
- Покрытия, прошедшие гальванику, характеризуются равномерной толщиной и высочайшим уровнем плотности.
- Гальваническое покрытие можно с легкостью наносить даже на конструкции сложной формы.
- Покрытие, появившееся при гальванической обработке, отличается хорошей адгезией со многими металлами.
- Декоративные и защитные свойства деталей, прошедших гальванику, очень высоки.
- Толщина гальванического покрытия очень просто регулируется.
Кстати, слово «гальваника» встречается не только в промышленных сферах деятельности и ювелирном производстве, но и в косметологии. Так называется процесс, при котором на кожный покров воздействуют маломощными токами, позволяющими избавиться от излишков жира сальных желез.
Что нужно для приготовления электролита?
Как сделать электролит дома? Сначала выберем правильную посуду для хранения: это должна быть емкость из неактивного вещества (стекла или пластика), прочная, плотно закрывающаяся крышкой, чтобы избежать доступ кислорода для электролита.
Химия – наука точная. Каждое используемое вещество придется отмерять с точностью до сотых грамма. Вам потребуется качественное весовое оборудование, удобнее всего электронное. Если возможности или желания купить весы нет – берите мелочь советского периода, монеты тогда имели точный вес.
Самое труднодоступное для простого гражданина – приобретение реактивов для изготовления электролита. Многие вещества запрещены к продаже физическим лицам, только промышленным предприятиям при наличии особого разрешения. Простым людям опасные реактивы не продадут!
На видео: Ток 60А в домашних условиях или кустарная гальваника.
Совместимость металлов
Контактная коррозия случается при взаимодействии 2 разнородных металлов. Так, запрещено соединять листы алюминия с помощью медной заклепки, поскольку это приведет к образованию сильной гальванической пары.
Различные металлы различаются электродными потенциалами. При контакте с электролитом один становится катодом, а другой анодом. В ходе химической реакции начинается коррозия, при которой медь (катод) беспощадно уничтожает алюминий (анод).
Практически все разнородные материалы, контактирующие друг с другом, не защищены от образования ржавчины, т.к. даже частицы влаги, содержащиеся в воздухе, могут превратиться в электролит и запустить электродный потенциал.
Ознакомиться с совместимостью гальванических пар можно с помощью таблицы:
| Алюминий | Латунь | Бронза | Медь | Оцинкованная сталь | Железо | |
| Алюминий | Д | Н | Н | Н | Д | О |
| Медь | Н | О | О | Д | О | Н |
| Свинец | О | О | О | О | Д | Д |
| Цинк | Д | Н | Н | Н | Д | Н |
Д — допустимые контакты (минимальный риск ГК). О — ограниченно допустимые контакты (средний риск ГК).
Н — недопустимые контакты (повышенная вероятность ГК).
Толщина серебрения в зависимости от условий эксплуатации и назначения деталей
Серебро отличается устойчивостью к щелочным растворам и большинству органических кислот, концентрированная серная кислота может растворять металл только при кипячении, а соляная при значительном нагревании. Под воздействием аммиака и хлора на поверхности серебра образуется тонкая пленка, повышающая значения сопротивлений и затрудняющая процесс пайки, металл теряет свои преимущества. Для предупреждения негативных явлений применяется специальная технология финишной обработки.
Особые физико-химические характеристики покрытия определяют метод серебрения и конкретную область использования покрытий, покрытие широко распространено вне зависимости от высокой стоимости и дефицитности металла. Серебрение изделий применяется для повышения отражательных характеристик оптических и светотехнических приборов, для понижения переходного сопротивления и деталей, контактирующих между собой, для повышений устойчивости к коррозионным процессам и в декоративных целях при изготовлении ювелирных изделий.





































